خدمات ژنتیک مولکولی و سیتوژنتیک
برخی از تکنیک های ارائه شده در هیستوژنوتک
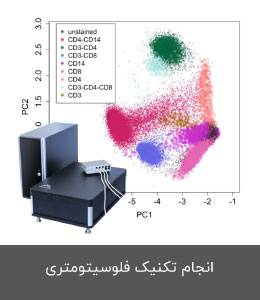
- انجام تکنیک الایزا، وسترن بلات و فلوسیتومتری
- ترانسفورماسیون باکتری با وکتور با روش شیمیایی و الکتروپوریشن
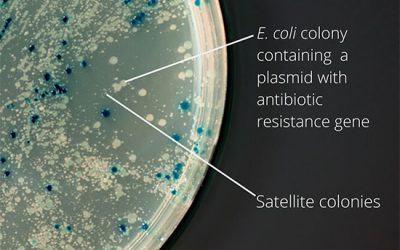
- کشت کلونی باکتری، تخلیص پلاسمید، ایجاد ویروس از وکتور
- انجام کلونی PCR در وکتورهای بیانی
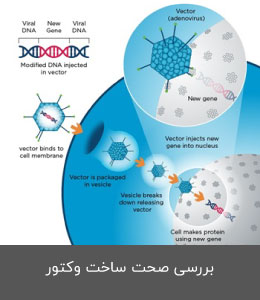
- طراحی، سفارش و بررسی صحت ساخت وکتور
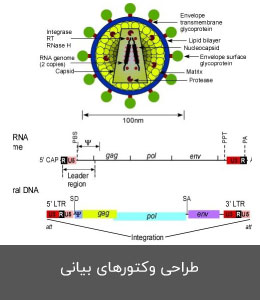
- طراحی وکتورهای بیانی
- ترانسداکشن سلول با ویروس
- نشاندار کردن سلول با وکتور GFP
- تولید رده سلول های نوترکیب
- کلونینگ و بیان پروتئین
- تکنیک SDS PAGE
- رنگ آمیزی کوماسی بلو

امروزه با توجه به افزایش تحقیقات در علم ژنتیک به ویژه در کشور ما، کاربرد انواع تست های ژنتیکی در زمینه های تحقیقات سلول های بنیادی، تشخیصی، درمانی، پیش آگهی و بسیاری از حوزه های دیگر از اهمیت بسزایی برخوردار می باشد. آزمایشگاه تحقیقاتی بافت و ژن پاسارگاد هیستوژنوتک بر آن است تا پس از معرفی مختصری از انواع تستهای ژنتیکی بر اساس هدف کاربردی آن ها، به معرفی فرآیندها، کاربردها، معایب و مزایای برخی از پرکاربردترین تستهای ژنتیکی در دو حوزه سیتوژنتیک و ژنتیک ملکولی بپردازد.