خدمات سلولی مبتنی بر آخرین متد ها و مقالات روز دنیا

خدمات سلولی مبتنی بر آخرین متد ها و مقالات روز دنیا
سلول شناسی (Cytology) با بررسی ساختار، نیازهای غذایی و علل توقف رشد در طی مطالعه چرخه رشد سلولی، توسعه روش های کنترل رشد سلول های سرطانی و تعدیل بیان ژنها منجر به افزایش دانش بشر در روند تکامل جانداران شده است. استفاده از تکنیک های کشت سلولی کمک شایانی در مطالعات ژنتیکی ( از جمله تولید حیوانات ترانس ژنیکی که بتوانند ژنهای خاصی را بیان کنند) از طریق وارد کردن یک ژن بیگانه به داخل ژنوم سلولی داشته است. به علاوه تکنولوژی ممزوج کردن سلولها که عمدتاً در تولید آنتی بادی های مونوکلونال کاربرد دارد و همچنین انجام آزمایشات سم شناسی نیاز به کشت و نگهداری این سلولها در محیط آزمایشگاهی دارد.
برخی از تکنیک های سلولی ارائه شده در هیستوژنوتک
- جداسازی و کشت سلول از انواع مختلف بافت های بدن
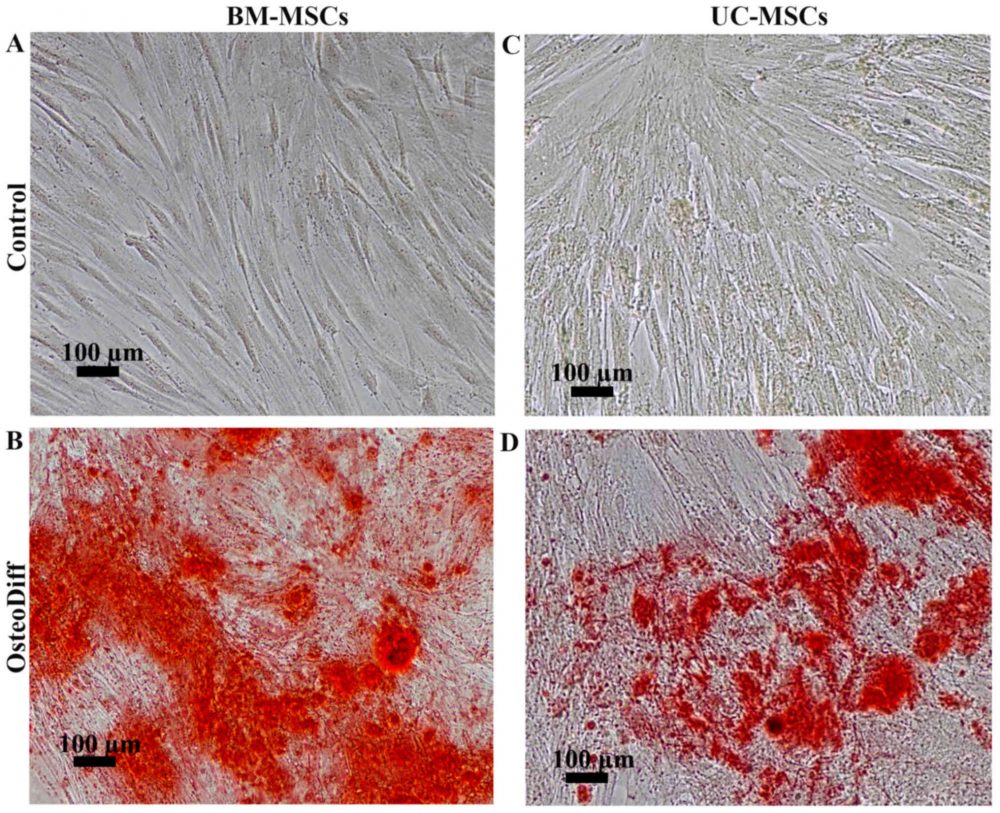
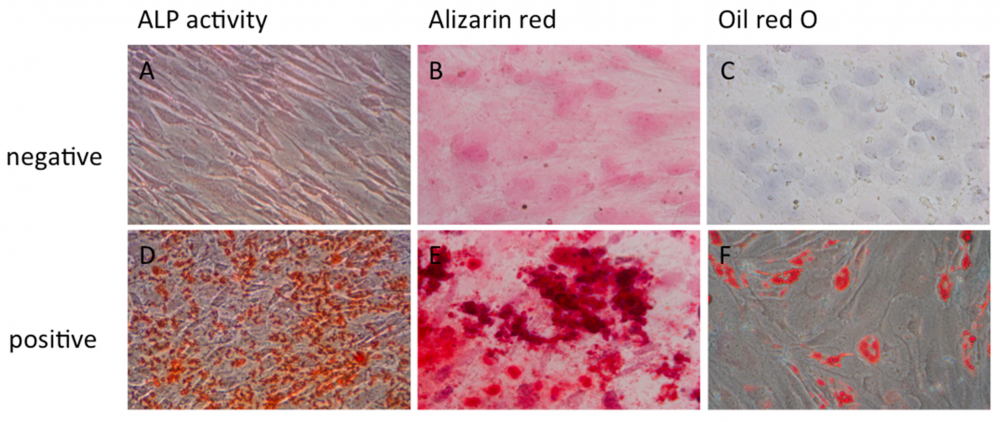
- تمایز سلول های کشت داده شده به رده های مختلف سلولی
- تاًیید ماهیت سلول های تمایز یافته با روش ICC
- بررسی میزان آپوپتوز سلولی به روش فلوسیتومتری
- بررسی میزان بقاء و تکثیر سلولی
- بررسی میزان استرس اکسیداتیو سلولی با روش فلوسیتومتری
- بررسی میزان آنتی اکسیدان سلولی با روش اسپکتروفلوریمتری
- بررسی میزان لیپید پراکسیداسیون سلولی
- بررسی چرخه میتوز در سلول های در حال تقسیم
- بررسی قرارگیری سلول بر روی داربست بافتی
- پیوند سلول از خون به صورت IP ، زیر کپسول کلیه و عضلانی
- ردیابی سلول های پیوند زده شده
- جداسازی سلول بر اساس مارکرهای سطحی با روش MACS
- بررسی میزان رشد، تکثیر و مرگ و میر سلولی با روش MTT
مطالب علمی مرتبط: اصطلاحات کشت سلولی و اجزای محیط کشت – مراحل چرخه سلولی و تفکیک سلول ها
محصولات مرتبط: محیط های کشت تمایزی – داربست های مهندسی بافت