تکنیک ایمونوهیستوشیمی IHC
آموزش قدم به قدم مراحل انواع روش های ایمونوهیستوشیمی + کاربرد ها و نحوه تفسیر نتایج

تکنیک ایمونوهیستوشیمی (Immunohistochemistry)، یک روش در آزمایشگاه بافتشناسی و ترکیبی از تکنیکهای بیوشیمی، ایمونولوژی و آناتومی جهت تصویربرداری از اجزای مجزا در انواع بافت های بدن موجودات زنده و غیر زنده می باشد. در این مطلب از شرکت دانش بنیان بافت و ژن پاسارگاد با روش انجام قدم به قدم ایمونوهیستوشیمی، کاربرد های آن، نحوه تفسیر نتایج آشنا خواهید شد. با ما همراه باشید.
⭐ آنچه در این مطلب خواهید خواند
تکنیک IHC یا ایمونوهیستوشیمی چیست؟
روش ایمونوهیستوشیمی بر اساس شناسایی و مکان یابی انواع آنتی ژن ها یا پروتئین ها با استفاده از فعل و انفعالات آنتیژن آنتیبادی، در سلولها و یا یک بخشی از بافت است. تکنیک ایمونوهیستوشیمی به عنوان ابزاری قدرتمند در آزمایشگاههای تشخیصی و تحقیقاتی در تشخیص و ردیابی انواع سرطانها مانند Breast Cancer (سرطان پستان) در زنان، بیماریهای نئوپلاستیک مورد استفاده قرار گرفته است.
در نیم قرن گذشته، پیشرفت فوقالعادهای در تولید ابزارها و سیستمهای ردیابی آنتی بادی به دست آمده است.با این حال اکثر قریب به اتفاق این تلاشها، در جهت آنالیز بیشتر بیان پروتئین به عنوان نشانگر انواع سلول، بافت یا تومور خاص مورد استفاده قرار گرفته است.استفاده از روش های تحقیقاتی ایمونولوژیک در هیستوپاتولوژی منجر به بهبودی چشمگیری در تشخیص میکروسکوپی نئوپلاسم شده است. گرچه آنالیز بافت شناسی مقاطع بافتی رنگ شده با هماتوکسیلین و ائوزین همچنان به عنوان هسته اصلی پاتولوژی باقی مانده است، اما ایمونوهیستوشیمی به ابزاری قدرتمند در اختیار پاتولوژیست ها تبدیل شده است.
IHC در پاتولوژی چیست؟
ایمونوهیستوشیمی در پاتولوژی، به عنوان یک روش رنگ آمیزی جهت سنجش کیفی و کمی پروتئین های بیان شده از جمله انواع آنتیژن ها (مارکرها) در بیماریها و مسیرهای سیگنالینگ می باشد که با استفاده از انواع مارکرهای قابل رویت مانند رنگ فلوئورسنت، آنزیم ها و المنت های رادیواکتیو انجام می شود. علاوه بر کاربردهای تحقیقاتی، آزمایش IHC برای تشخیص سرطان ها، آنتی ژن های اختصاصی تومورها بر پایه آنتی بادی های مونوکلونال و پلی کلونال مورد استفاده گسترده قرار گرفته است.

تاریخچه ایمونوهیستوشیمی
اصول ایمونوهیستوشیمی از دهه ۱۹۳۰ شناخته شده است اما اولین مطالعه این تکنیک در سال ۱۹۴۲ گزارش شده است بدین صورت که محققی بنام Coons و همکارانش با استفاده از آنتی بادیهای نشاندار شده با FITC (fluorescein isothiocyanate) آنتیژنهای پنوموکوکی در بافتهای آلوده به این باکتری را شناسایی کردند. از آن زمان به بعد پیشرفت چشمگیری در روشهای رنگآمیزی ایمنی و تصویربرداری با میکروسکوپ نوری مشاهده شد. در نتیجه ایمونوهیستوشیمی روشی رایج و ضروری برای پاتولوژیستها تبدیل شده است. Immunohistochemistry یا به اختصار IHC ، نام خود را از ریشه immuno با اشاره به آنتیبادی های مورد استفاده در این تکنیک و Histo به معنی بافت گرفته است.
ویدیو آموزش تکنیک ایمونوهیستوشیمی
مراحل کلی پروتکل به روایت تصویر







کاربردهای آزمایش IHC
امروزه از تکنیک ایمونوهیستوشیمی در آزمایشگاههای تشخیصی طبی و مراکز تحقیقاتی استفاده گسترده ای دارد. کاربردهای تکنیک IHC عبارتند از:
- تشخیص بیماری ها از جمله تومورها و سلولهای سرطانی
- تحقیقات بیولوژیکی، پزشکی و دامپزشکی
- توسعه و طراحی دارو جهت درمان بیماریها
- بررسی فرایند تمایز بافتی به واسطه شناسایی مارکرهای سطحی
به عنوان مثال پزشکان با استفاده از تکنیک ایمونوهیستوشیمی برای تشخیص خوش خیم یا بدخیم بودن تومور، تعیین مرحله و درجه پیشرفت آن، شناسایی نوع سلول و منشا متاستاز به منظور یافت یافتن محل تومور اولیه استفاده می کنند. برای مثال با استفاده از مارکرهای اختصاصی مثل مارکر Synaptophysin در تومورهای نورواندوکرین، منشا و ماهیت تومور جهت درمان صحیح تشخیص داده می شود.
در زمینه تحقیقاتی، IHC را میتوان به تنهایی یا همراه با تکنیک های آزمایشگاهی دیگر برای مطالعه و بررسی رشد بافتها و اندام طبیعی، فرایندهای پاتولوژی مثل بهبود زخم، مرگ و ترمیم سلولی و بسیاری زمینه های دیگر مورد استفاده قرار داد.
جهت مشاوره رایگان با تماس بگیرید
۰۲۱۶۶۱۲۱۹۸۱
تکنیک Ihc به روش مستقیم و غیر مستقیم
تکنیک ایمونوهیستوشیمی همچنین در زمینه تحقیقات دارویی و صنعت داروسازی برای آزمایش میزان اثربخشی دارو به واسطه شناسایی فعالیت و کاهش و افزایش مارکرهای بیماری در بافت های هدف کاربرد گسترده ای دارد.
همانطور که بیان شد، ایمونوهیستوشیمی متدی بر مبنای رنگ آمیزی ایمنی بخشهای نازک برش زده از بافت روی
لامهای شیشه ای به دنبال ردیابی آنتیژنها با استفاده از آنتیبادی های کنژوگه شده با مواد فلوئورسنت، آنزیمها و یا عناصر رادیواکتیو می باشد. با اتصال آنتی بادی اختصاصی آنتی ژن هدف در سطح سلول و تولید رنگ طی واکنش، با میکروسکوپ نوری می توان محصول رنگی را که نشاندهنده مکان بیان آنتی ژن است، تشخیص داد. آنتی بادی های اختصاصی مونوکلونال در تکنیک ایمونوهیستوشیمی از طریق تزریق آنتی ژن های مختلف به حیوانات آزمایشگاهی مانند خرگوش و تحریک سیستم ایمنی بدن حیوان و به دنبال آن تولید آنتی بادی طی تمایز لنفوسیت های B انجام می شود. متداول ترین آنتی بادی ها از گروه IgG است. با وجود اینکه آنتی بادی های پلیکلونال میل ترکیبی بیشتر دارند، اما به علت اختصاصیت کمتری نسبت به آنتی بادیهای مونوکلونال، کمتر استفاده می شوند. مزیت استفاده از آنتی بادی های پلیکلونال این است که نسبت به آنتی بادی مونوکلونال، می توانند چند اپیتوپ (Epitope) از آنتی ژن هدف را شناسایی کنند.
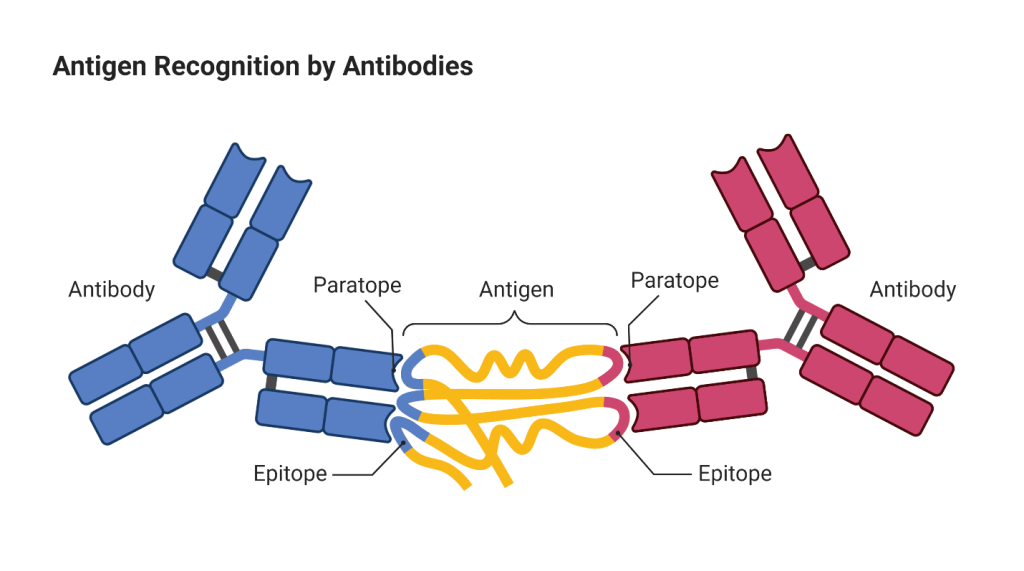
جهت نشان دادن واکنش آنتی بادی و آنتی ژن از کنژوگههای استفاده می شود که به آنتی بادی ها متصل شده و در حضور سوبسترای اختصاصی و کروموژن، یک محلول رنگی تولید می کنند. این محلول رنگی در محل واکنش آنتی بادی و آنتی ژن رسوب کرده و زیر میکروسکوپ قابل دیدن است.
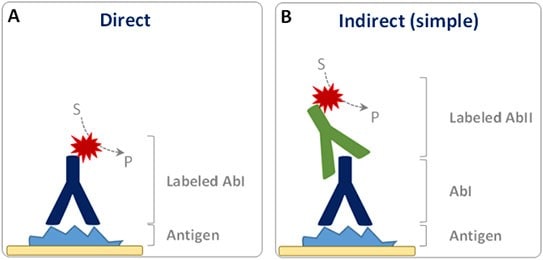
واکنش رنگ آمیزی ایمونوهیستوشیمی تکنیک IHC با دو روش مستقیم و غیر مستقیم انجام می شود. این دو روش عبارتند از:
- در روش مستقیم (Direct method) واکنش رنگ آمیزی ایمونوهیستوشیمی یک مرحله ای است که آنتی بادی اولیه کنژوگه مستقیما با آنتیژن های سطح سلولها در نمونه موردنظر واکنش می دهد. این روش اگر چه آسان، سریع و کم هزینه (به علت استفاده از یک نوع آنتی بادی) است ولی حساسیت پایین به علت سیگنال نوری کم دارد بنابراین روش مناسب جهت تشخیص ماکرها نمی باشد.
- در روش دوم یعنی غیرمستقیم (Indirect method)، واکنش رنگ آمیزی دو مرحلهای است که ابتدا آنتیبادی اولیه (نشاندار نشده) به آنتی ژن هدف متصل شده و سپس آنتیبادی ثانویه کنژوگه شده به آنتیبادی اولیه متصل می گردد. در این روش آنتی بادی ثانویه علیه IgG گونه های حیوانی است که از آن آنتی بادی اولیه تهیه شده است. همچنین آنتی بادی ثانویه با رنگ فلوئورسنت مانند FITC، رودامین، Texas red و یا با آنزیمهایی از جمله پراکسیداز، آلکالین فسفاتاز یا گلوکز اکسیداز نشاندار میشود. حساسیت این روش نسبت به روش مستقیم بیشتر است. چون آنتی بادی ثانویه سبب حفظ فعالیت و در نتیجه تقویت سیگنال می شود.
انواع روش های ایمونوهیستوشیمی
- نوری
- فلورسنت
- دابل فلورسنت
تکنیک ایمونوهیستوشیمی به روش نوری
برای اطلاع از انواع آنتی بادی های موجود و دریافت مشاوره رایگان در مورد مسیر های سیگنالینگ انواع آنتی بادی ها اینجا کلیک کنید
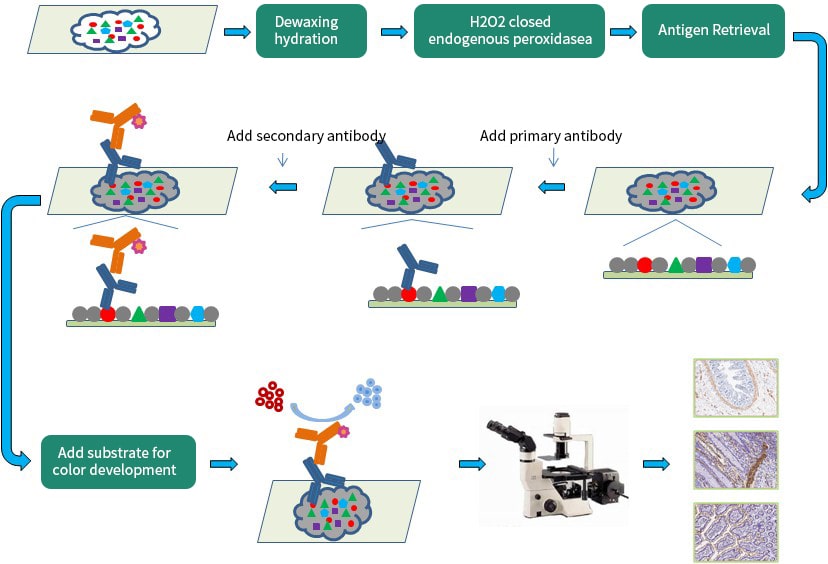
- استخراج و فیکس کردن بافت هدف: اولین مرحله انجام تست ایمنوهیستوشیمی آماده سازی نمونه بیولوژیکی است. آماده سازی و کیفیت نمونه در تشخیص و ردیابی صحیح آنتیژن هدف نقش مهمی ایفا میکند. منبع نمونه بافتی متنوع است. می تواند از روش بیوپسی، جراحی، مدل حیوانی و یا اتوپسی(autopsy) تهیه شده باشد. در سه نوع اول، بافت تازه را در اختیار پاتولوژیست قرار داده ولی در روش اتوپسی حداکثر تا دو ساعت بعد از مرگ موجود هدف، بافت تهیه می شود. بنابراین می بایست فوری بافت تهیه شده به روش اتوپسی را جهت جلوگیری از تجزیه آنتیژن، فیکس کرد. بنابراین بافت مورد مطالعه می تواند فیکس شده با پارافین جامد، محلول فرمالدئید یا فریز شده باشد. اکثر بافت های مورد استفاده در تکنیک IHC فیکس شده در پارافین هستند.
فیکس کردن بافت مورد نظر، از طریق غوطه ور کردن آن برای ۲۴ تا ۴۸ ساعت در فرمالین ۱۰ درصد انجام می شود. - تهیه آنتی بادی اختصاصی آنتی ژن: از آنجا که آنتی بای قیمت بالایی دارد بنابراین می بایست از کمپانی مطمئن و با کیفیت بالا خریداری کنیم. در غیر صورت عدم دقت در تهیه آنتیبادی میتواند هزینه گزافی را به محقق و آزمایشگاه تحمیل کند.
- مراحل پردازش بافتی (Tissue Processing) شامل مرحله آبگیری با غلظت های مختلف اتانول
- مرحله آبگیری: به دلیل عدم حلالیت پارافین در آب، باید قبل از غوطه ور کردن بافت در پارافین مرحله آبگیری را انجام دهیم. بافت ها را در محلول اتانول با غلظت های ۷۰ ، ۸۰ و ۹۵ درصد هر کدام به مدت ۴۵ دقیقه قرار می دهیم سپس بافت ها را ۳ بار در اتانول ۱۰۰ درصد به صورت جداگانه هر بار ۱۰۰ دقیقه انکوبه می نمائیم.
- مرحله شست و شو و شفاف سازی : بعد از انجام مراحل آبگیری، جهت شستشوی مواد مرحله قبل از زایلین استفاده میکنیم به این صورت که بافت ها را در دو ظرف جداگانه محلول زایلین (زایلول) هر کدام را به مدت یک ساعت انکوبه می کنیم.
- بافت ها را به ترتیب در سه ظرف جداگانه پارافین هر کدام به مدت یک ساعت غوطه ور می کنیم.
- بافت ها را داخل بلوک های پارافینی جایگذاری می کنیم
- برش بافت پارافینی و تهیه لام: با استفاده از دستگاه میکروتوم برش داده و قطعات برش زده را به لام انتقال می دهیم.
- مرحله آبدهی: پس از چسبیدن برش بافت به لام بایستی پارافین را از بافت جدا کنیم که نیاز به آبدهی بافت می باشد. مرحله آبدهی برعکس مرحله آبگیری انجام می شود.
- دپارافینه کردن بافت ها: لام ها را در دو ظرف جداگانه زایلن هر کدام را به مدت ۵ دقیقه قرار می دهیم و سپس لام ها را دو مرتبه و هربار به مدت ۳ دقیقه در اتانول ۱۰۰ درصد و سپس یک بار و به مدت ۳ دقیقه در هر یک از غلظت های ۵۰ ، ۷۰ و ۹۵ اتانول قرار می دهیم. نهایتا اجازه می دهیم بافت ها به مدت یک شب در دمای اتاق خشک شوند.
- بلاک کردن آنزیم پراکسیداز سلولی :به منظور بلاک کردن فعالیت پراکسیداز سلولی لام ها را در محلول متانول حاوی آب اکسیژنه ۳ درصد یا ExtrAvidin-Peroxidase برای مدت ۱۰ دقیقه انکوبه می کنیم. بعد از آن، دو بار و هر بار ۵ دقیقه بهوسیله محلول بافری PBS شستشو می دهیم.
- در معرض قرارگیری اپی توپ های آنتی ژن: بدین منظور، لام ها را داخل یک ظرف قرار داده و روی آن بافر سیترات ریخته و ظرف را به مدت ۱۰ دقیقه در دمای ۹۵ تا ۱۰۰ درجه سانتی گراد حرارت می دهیم. سپس ظرف را برای مدت ۲۰ دقیقه در دمای اتاق می گذاریم تا سرد شود.
- مرحله شستشو: لام ها را دو مرتبه و هر بار برای مدت ۵ دقیقه با محلول بافری PBS شستشو می دهیم.
- مقدار مناسبی از بلاکینگ بافر (مثلا سرم ۱۰% fetal bovine serum in PBS) روی هر لام ریخته و سپس برای مدت یک ساعت در دمای اتاق قرار داده و سپس با PBS شستشو می دهیم.
- واکنش آنتیبادی اولیه: مقدار مناسبی از آنتی بادی اولیه رقیق شده را روی بافتها ریخته و برای یک ساعت در دمای انکوبه کرده و سپس دو بار با محلول PBS و هر بار ۵ دقیقه شستشو می دهیم.
- واکنش آنتیبادی ثانویه: مقدار مناسبی از آنتی بادی ثانویه رقیق شده را بر روی هر لام ریخته و به مدت ۳۰ دقیقه در دمای اتاق قرار می دهیم سپس لام ها را دو بار با محلول PBS و هر بار به مدت ۵ دقیقه شستشو می دهیم.
- مقدار مناسبی از Sav-HRP رقیق شده را بر روی بافت ها ریخته و برای ۳۰ دقیقه در تاریکی قرار داده سپس لام ها را دو بار با محلول PBS و هر بار به مدت ۵ دقیقه شستشو می دهیم.
- بر روی هر بافت مقدار مناسبی از محلول DAB ریخته و پس از ۵ دقیقه انکوبه، ۳ مرتبه با محلول PBS شستشو می دهیم.
- لام ها را برای دو دقیقه داخل هماتوکسیلین قرار داده و سپس با آب شستشو می دهیم.
- لام ها را جهت آبگیری در اتانول ۹۵ و ۱۰۰ درصد هر کدام دو بار و هر بار ۵ دقیقه قرار می دهیم.
- لام ها را جهت شفاف شدن داخل زایلن قرارداده و سپس لام ها را با چسب انتلان مونت(Mounting) می کنیم.
- مرحله آخر بررسی و تصویربرداری از نمونه ها با میکروسکوپ نوری می باشد.
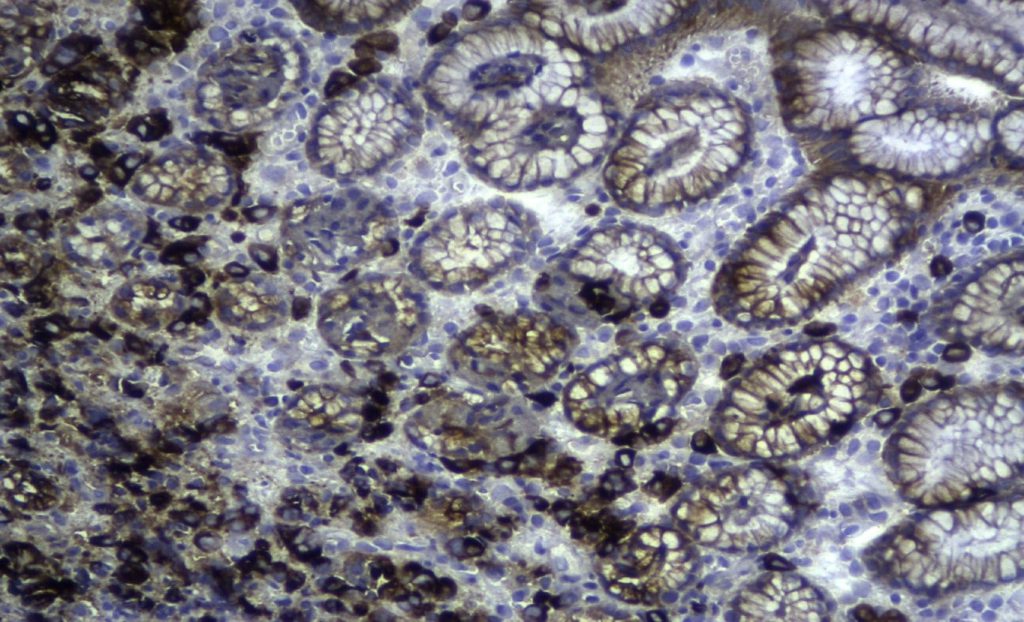
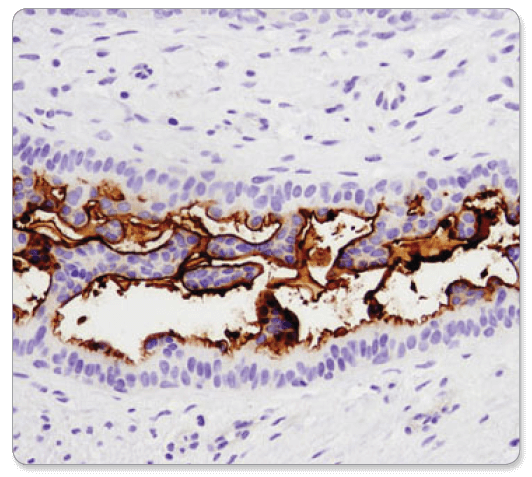
تکنیک ایمونوهیستوشیمی به روش فلورسنت
- فیکس کردن بافت هدف: در روش فلورسنت، بافت ها را در محلول فرمالین ۱۰ درصد به مدت ۴ تا ۸ ساعت در دمای اتاق فیکس می کنیم. معمولاً حجم فیکساتور باید ۵۰ برابر بیشتر از اندازه بافت غوطه ور باشد. از تثبیت بافت برای بیش از ۲۴ ساعت خودداری کنید زیرا آنتی ژن ها ممکن است پوشانده یا از بین بروند.
- مرحله آبگیری: از آنجایی که پارافین با آب غیر قابل اختلاط است، قبل از افزودن پارافین مذاب، بافت باید آبگیری شود. بافت ها را به ترتیب در اتانول های ۷۰ ، ۹۰ و ۱۰۰ هرکدام سه بار به مدت ۳۰ دقیقه در دمای اتاق انکوبه میکنیم.
- بافت را سه بار به مدت ۲۰ دقیقه در زایلن (گزیلول) در دمای اتاق غوطه ور میکنیم.
- بافت ها را در قالب های پارافینی قرار داده و با پارافین مذاب در دمای ۵۸ درجه سانتیگراد قالب گیری می کنیم.
- با استفاده از میکروتوم چرخشی، مقاطع بافتی به ضخامت ۵ تا ۱۵ میکرومتر را برش می دهیم.
- بافت های برش زده را در حمام آب ۵۶ درجه سانتی گراد شناور میکنیم.
- برشهای بافتی را روی لام های بافت شناسی قرار داده و اجازه می دهیم برش ها را یک شب در دمای اتاق خشک شود. برش های بافتی در پارافین را می توان در دمای اتاق یا در دمای ۲ تا ۸ درجه سانتیگراد برای چندین سال در جعبه های ذخیره سازی اسلاید نگهداری کرد.
- مرحله آبدهی مجدد مقاطع بافتی: در این مرحله از رقت های مختلف اتانول استفاده میکنیم.
- بلوکهای بافتی را ۲ مرتبه به مدت ۱۰ دقیقه در زایلن (گزیلول) قرار میدهیم.
- اکنون بلوک ها را ۲ مرتبه به مدت ۱۰ دقیقه در اتانول ۱۰۰ درصد غوطه ور میکنیم.
- نمونه های فیکس شده را به مدت ۵ دقیقه در اتانول ۹۵ درصد، سپس ۵ دقیقه در اتانول ۷۰ درصد و بعد از آن در اتانول ۵۰ درصد غوطه ور میکنیم.
- برش های بافتی را با آب دیونیزه شست و شو می دهیم.
- نهایتا برش ها را به مدت ۱۰ دقیقه در بافر PBS شست و شو غوطه ور کرده و سپس بافر اضافی را تخلیه می کنیم.
نکته: تثبیت بیش از حد ممکن است منجر به پوشانده شدن یک اپیتوپ و سیگنال پس زمینه غیر اختصاصی قوی شود. در صورت لزوم، پروتکل بازیابی آنتی ژن را می توان در این زمان انجام داد.
برای جلوگیری از هدر رفت آنتی بادی، اطراف بافت را با یک مانع آبگریز (قلم داکو پن) خط میکشیم. - با انکوبه کردن نمونه ها در بافر مسدود کننده (سرم اسب ۱% در PBS )به مدت ۳۰ دقیقه در دمای اتاق، رنگآمیزی غیر اختصاصی بین آنتیبادیهای اولیه و بافت را مسدود می کنیم.
- آنتیبادی های اولیه رقیق شده در بافر انکوباسیون را طبق دستورالعمل سازنده آنتی بادی، به لام ها اضافه میکنیم
- برای رنگآمیزی فلورسنت IHC توصیه میشود برش های بافتی که در طول شب در دمای ۸-۲ درجه سانتیگراد انکوبه شود. انکوباسیون امکان اتصال اختصاصی بهینه آنتی بادی ها به اهداف بافتی را فراهم می کند و رنگ آمیزی غیر اختصاصی پس زمینه را کاهش می دهد.
- برش های بافتی را ۳ بار به مدت ۱۵ دقیقه در بافر شستوشو می دهیم. آنتی بادی ثانویه رقیق شده در بافر انکوباسیون را طبق دستورالعمل شرکت سازنده به بافت ها افزوده و انکوبه می کنیم.
نکته: از این مرحله به بعد، نمونه ها باید از نور محافظت شوند. - بافت ها را ۳ بار به مدت ۱۵ دقیقه در بافر شستشو قرار میدهیم.
- ۳۰۰ میکرولیتر از محلول DAPI رقیق شده را به هر چاهک اضافه کرده و ۳۰ دقیقه در دمای اتاق و در تاریکی انکوبه می کنیم. DAPI به DNA متصل می شود و هسته سلول ها را رنگ آمیزی می کند.
- لام ها را یک بار محلول PBS1X شستشو می دهیم و با استفاده از محلول گلیسرول-PBS لام ها را مونت می کنیم.
- مرحله آخر بررسی و تصویربرداری از نمونه ها با میکروسکوپ فلورسنت می باشد.
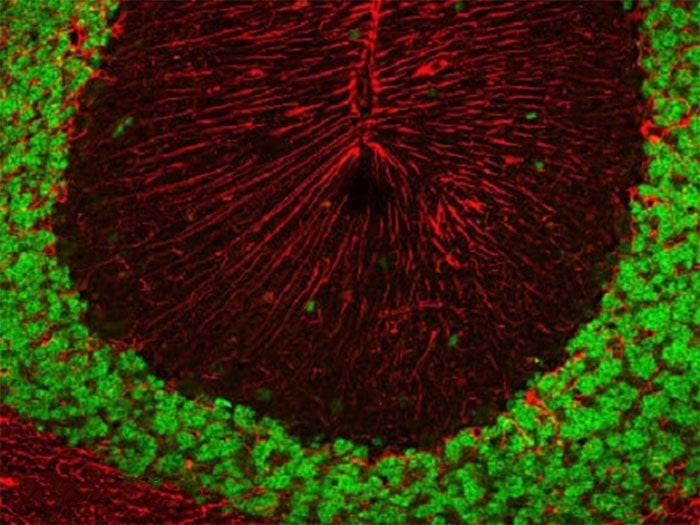
مطلب پیشنهادی: آنتی بادی ها در تست های آزمایشگاهی – انواع آنتی اکسیدان ها و رادیکال های آزاد
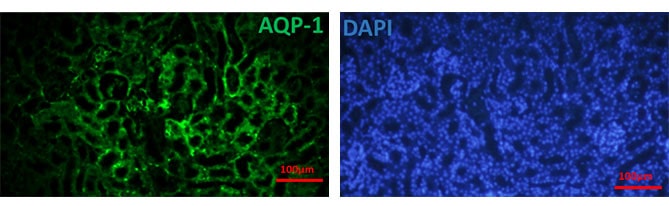
مراحل تکنیک ایمونوهیستوشیمی به روش دابل فلورسنت
روش دابل فلورسنت برای زمانی مورد استفاده قرار می گیرد که هدف ما از تکنیک ایمونوهیستوشیمی، بررسی دو مارکر یا آنتی ژن در نمونه هدف بصورت همزمان می باشد.
در این روش، کلیه مراحل آماده سازی نمونه کاملا مشابه ایمونوهیستوشیمی به روش فلورسنت می باشد و تنها تفاوت آن، استفاده از دو آنتی بادی اولیه و دو آنتی بادی ثانویه به طور همزمان می باشد و در نتایج نهایی مارکرها با رنگ های آبی و قرمز در تصاویر فلورسنت نمایان می شود.
نمونه های بافتی را در مخلوط دو آنتی بادی اولیه در رقت مناسب در بافر رقت آنتی بادی به مدت ۱ ساعت در دمای اتاق انکوبه کنید. برش های بافتی را در PBS-Tween 20 به مدت ۳ بار و هر بار ۲ دقیقه شستشو دهید. سپس با مخلوط دو آنتی بادی ثانویه کونژوگه به عنوان مثال آنتی بادی ثانویه کونژوگه با(FITC conjugated Horse Anti-Mouse) و Texas Red conjugated Goat anti-rabbit) در PBS به مدت ۳۰ دقیقه در دمای اتاق انکوبه کنید. نمونه ها را در PBS-Tween 20 به مدت ۳ بار و هر بار ۲ دقیقه شستشو دهید. در صورت نیاز به مدت ۲۰ دقیقه در دمای اتاق، هسته ها را با DAPI رنگ آمیزی کنید.
برش ها را در PBS-Tween 20 به مدت ۳ بار و هر بار ۲ دقیقه شستشو دهید وسپس مونت کنید.
اکنون نمونه ها برای مطالعه زیر میکروسکوپ فلورسنت آماده می باشند.
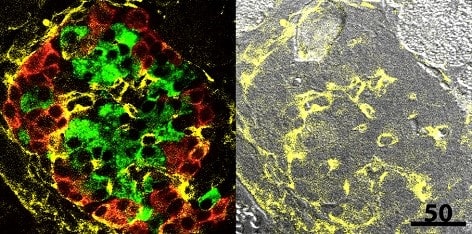
نکته: قبل از ایمونوهیستوشیمی دابل فلورسنت، مهم است که هر آنتی بادی اولیه را به صورت جداگانه آزمایش شود و بهترین پیش تیمار را برای هر آنتی بادی انتخاب گردد. اگر دو آنتی بادی اولیه نیاز به پیش تیمار مشابه داشته باشند، ایدهآل خواهند بود. در غیر این صورت، باید برای مقاطع پیش تیمار جداگانه و سپس ایمونوهیستوشیمی برای هر آنتی بادی به صورت جداگانه انجام داد. اگر هر دو آنتیبادی به پیش تیمارهای مضاعف پاسخ دادند، شرایط برای استفاده از تکنیک ایمونوهیستوشیمی دابل فلورسنت فراهم می باشد.
پیش تیمار مقاطع بافتی
اپی توپ آنتی ژن های موجود در بافتها می توانند به صورت متقاطع به یکدیگر متصل و یا کاملا پوشیده شوند که اتصال آنتی ژن به آنتی بادی را دشوار می کند. با پیش تیمار از طریق معرف یا روشهای بازیابی آنتی ژن می توان به طور قابل توجهی اپی توپ های متقاطع را باز کرد تا آنتی بادی ها به راحتی به آنتی ژنهای هدف متصل شوند. چندین روش برای بازیابی آنتی ژن ها از جمله بازیابی گرمایی و بازیابی آنزیم و غیره پیشنهاد شده است.
بازیابی آنتیژن ها با گرما
در این روش، مقاطع را در ظرف حاوی بافر سیترات (pH 6.0) قرار داده و ظرف را در دستگاه بخار قرار می دهیم. دما را روی ۱۰۰ درجه سانتیگراد تنظیم و اجازه می دهیم تا ۲۰ دقیقه بجوشد. برای این منظور می توان از دستگاه های دیگری مانند مایکروفر نیز استفاده کرد.
بازیابی آنزیمی
پروتئیناز k، تریپسین، کیموتریپسین، پپسین و پروتئازهای مختلف دیگر را می توان برای بازیابی آنتی ژن از بافت فیکس شده با فرمالین استفاده کرد. غلظت و زمان تیمار بسته به زمان فیکساسیون و غلظت متفاوت میباشد.
ترکیب بازیابی گرمایی و بازیابی آنزیمی
این روش می تواند به عنوان انتخاب دوم زمانی که بازیابی گرمایی یا بازیابی آنزیمی به خوبی کار نمی کند استفاده شود. شرایطی مانند زمان تیمار و غلظت آنزیم باید ستاپ شود.
تیمار با سدیم تترا هیدروبورات (Sodium borohydride)
از تیمار بوروهیدرید سدیم (۱% در بافر فسفات) می توان برای بازیابی آنتی ژن از بافت فیکس شده در فرمالین استفاده کرد. از این روش برای بازیابی آنتی ژن ها در بافت های فیکس شده گلوتارالدئید نیز مناسب است. زمان تیمار باید قبل از انجام فرآیند ستاپ شود.
توجه: تریتون X-100 برای بازیابی آنتی ژن زمانی که آنتی ژن ها در سطح سلول های موضعی هستند مناسب نیست، زیرا تریتون X-100 ساختار غشایی را تخریب می کند.
جمع بندی
تا به امروز در تحقیقات زیست پزشکی، IHC به عنوان یک متد آزمایشگاهی به موازات تکنیک های تجربی دیگر کاربرد دارد. همانطور که در این مقاله توضیح داده شد، رعایت دستورالعملها و نکات مهم در پروتکل IHC برای اطمینان از دادههای قابل اعتماد و قابل تکرار بسیار مهم است. در جستجو و شناسایی مولکولهای زیستی که نقش مهمی در سیگنالدهی درد مانند درد دندان دارند، دادههای IHC نتایج آناتومیکی و فیزیولوژیکی را ارائه کردهاند که محققان را برای حرکت به جلو و پیشرفت در این حوزه تحقیقاتی هدایت میکند. بنابراین تکنیک ایمونوهیستوشیمی یک روش مقرون بصرفه و با حساسیت بالا جهت تشخیص، درمان و تحقیق انواع بیماری ها در حوزه های مختلف پزشکی از جمله پاتولوژی می باشد.
مطالب مرتبط: تکنیک ایمونوسیتوشیمی – تست تانل – تکنیک وسترن بلات – آنتی بادی ها در تست های آزمایشگاهی
خدمات مرتبط: بافت شناسی، مهندسی بافت و رنگ آمیزی های پاتولوژی








با سلام
یکی از اشکالاتی که این مرکز وارد است تکرار آزمایشات از هر لام به تعداد سه بار می باشد که بار مالی به محقق تحمیل می کند .
همونطور که میدونید
تکرار ها در یک کار پژوهشی از لحاظ آنالیز آماری نتایج نه تنها به پژوهش شما اعتبار می بخشه که مورد توجه تمام مجلات علمی هست
از انجام دوباره تست ها در صورت مطلوب نبودن چند لام از تحمیل بار مالی و اتلاف وقت شما جلوگیری میکنه