راهنمای جامع مطالعات پیشبالینی (Preclinical Studies) در توسعه دارو
توسعه هر دارو ی جدید، قبل از اینکه بتواند وارد بدن انسان شود یا مجوز دریافت کند، نیازمند یک مرحله طلایی و غیرقابلحذف است
مرحله پیشبالینی (Preclinical Stage).
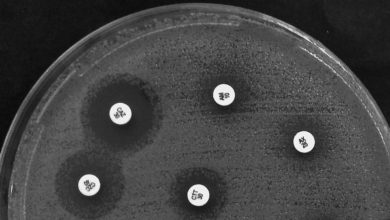
در این مرحله، تمام رفتار دارو در مدلهای حیوانی، پروفایل درمانی، ریسکها، عوارض جانبی و اثربخشی دارو (Drug Efficacy) باید با دقت اندازهگیری شود. بهطور خاص، مهمترین بخش این مسیر، ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) در قالب آزمایشهای حیوانی (Animal Testing) است.
سازمانهای قانونی بزرگ مانند سازمان غذا و دارو (FDA) و EMA بدون دادههای کافی از این مرحله بههیچ عنوان مجوز ورود به فاز انسانی نمیدهند. دریافت تأییدیه سازمان غذا و دارو (FDA Approval) مستقیم به کیفیت همین مرحله متکی است.
در نتیجه، هر شرکت دارویی، بیوتکنولوژی یا کلینیک تحقیقاتی که قصد دارد داروی جدید تولید کند، باید یک مسیر کاملاً علمی، مستند، قابل تکرار و منطبق با استانداردهای پیشبالینی (Preclinical) داشته باشد.
اهمیت مرحله پیشبالینی (Preclinical) در صنعت دارو
مرحله پیشبالینی (Preclinical) نقطهای است که در آن دارو برای اولین بار بر روی یک سیستم زنده آزمایش میشود.
در این مرحله، باید مشخص شود که اثربخشی دارو (Drug Efficacy) واقعی چیست، چه دوزی عملکرد مطلوب دارد، و آیا دارو برای دریافت تأییدیه سازمان غذا و دارو (FDA Approval) ارزش دارد یا خیر.
دلایل اصلی اهمیت این مرحله:
۱. ارزیابی اثربخشی دارو (Drug Efficacy Evaluation)
آیا دارو اصلاً کار میکند؟
آیا توان درمانی دارد یا فقط یک مولکول بیاثر است؟
این مرحله باید ۱۰۰٪ علمی، دقیق و قابل تکرار باشد.
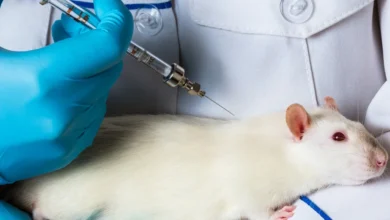
۲. انجام آزمایشهای حیوانی (Animal Testing)
بدون آزمایشهای حیوانی (Animal Testing)، هیچ داده زندهای درباره اثر دارو وجود ندارد.
این دادهها پایه گزارش نهایی برای سازمان غذا و دارو (FDA) هستند.
۳. امکان پیشبینی ایمنی انسانی
مرحله پیشبالینی (Preclinical) تعیین میکند آیا دارو در بدن انسان بیخطر خواهد بود یا نه.
۴. الزامات قانونی برای دریافت تأییدیه سازمان غذا و دارو (FDA Approval)
هیچ محصول درمانی بدون دادههای پیشبالینی (Preclinical Data) اجازه ورود به فاز انسانی را ندارد.
چرخه کامل مطالعات پیشبالینی (Preclinical Studies Workflow)
چرخه استاندارد شامل مراحل زیر است:
- طراحی پروتکل
- انتخاب مدلهای حیوانی (Animal Models)
- انجام آزمایشهای حیوانی (Animal Testing)
- تحلیل نتایج
- تفسیر اثربخشی دارو (Drug Efficacy)
- نگارش گزارش
- آمادهسازی مدارک برای سازمان غذا و دارو (FDA)
- سابمیت پرونده برای دریافت تأییدیه سازمان غذا و دارو (FDA Approval)
هر مرحله باید با استانداردهای GLP،ICH و OECD هماهنگ باشد.
استانداردهای بینالمللی در مطالعات پیشبالینی (Preclinical Regulations)
- FDA Guidance for Industry
- EMA Preclinical Requirements
- OECD Animal Testing Guidelines
- ICH Safety Guidelines
هر چیزی که ما در Vision of Research و Histogenotech انجام میدهیم باید برای روزی که مشتری بخواهد تأییدیه سازمان غذا و دارو (FDA Approval) بگیرد، آماده باشد.
مدلهای حیوانی در مطالعات پیشبالینی (Preclinical Animal Models)
و نقش آنها در ارزیابی اثربخشی دارو (Drug Efficacy Evaluation)
مدلهای حیوانی (Animal Models) ستون اصلی تحقیقات پیشبالینی (Preclinical) هستند.
بدون این مدلها هیچ نوع داده واقعی برای ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) وجود ندارد و هیچ مرجع قانونی از جمله سازمان غذا و دارو (FDA) اجازه ورود به فاز انسانی را صادر نمیکند.
در مرکز تحقیقاتی Vision of Research و Histogenotech، مدلهای حیوانی با دقت، استاندارد و تحت پروتکلهای GLP اجرا میشوند تا نتیجه نهایی برای دریافت تأییدیه سازمان غذا و دارو (FDA Approval) قابل اتکا باشد.
۱. مدلهای التهابی (Inflammation Animal Models)
این مدلها برای داروهای ضدالتهاب، آرتریت، درد و بیماریهای خودایمنی ضروری هستند و بخش ثابت مطالعات پیشبالینی (Preclinical) محسوب میشوند.
مدلهای حیوانی التهابی کلیدی یا مدلهای آزمایشگاهی التهاب و درد:
- ادم پنجه موش ناشی از کاراژینان (Carrageenan-Induced Paw Edema)
- آزمون درد-التهاب ناشی از فرمالین (Formalin Pain–Inflammation Test)
- آرتریت مزمن القاء شده با ادجوان کامل فروند (CFA-Induced Chronic Arthritis)
در هرکدام از این مدلها، اثربخشی دارو (Drug Efficacy) با پارامترهای بالینی و بافتی اندازهگیری میشود. دادهها برای ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) و مستندسازی پرونده سازمان غذا و دارو (FDA) حیاتی هستند.
۲. مدلهای سرطان (Oncology Animal Models)
یکی از پیشرفتهترین بخشهای آزمایشهای حیوانی (Animal Testing) است.
مدلهای سرطان حیوانی شامل:
- زنوگرافت (پیوند بافت انسان در موش) یا Xenograft
- سینژنیک (پیوند سلول در مدل همژن) یا Syngeneic
- اورتوتوپیک (پیوند در مکان طبیعی تومور) یا Orthotopic
- مدلهای متاستاز یا Metastasis Models
در این دسته، اندازهگیری اثربخشی دارو (Drug Efficacy) شامل:
- کاهش حجم تومور
- کاهش متاستاز
- افزایش بقا
- تغییر در بیومارکرها
است.
نتایج این بخش مستقیماً برای دریافت تأییدیه سازمان غذا و دارو (FDA Approval) در داروهای ضدسرطان استفاده میشود.
۳. مدلهای عفونت (Infection Models)
ضروری برای داروهای آنتیبیوتیک، ضدویروس، ضدقارچ و واکسنها. این مدلها باعث میشوند که در مرحله پیشبالینی (Preclinical) بتوانیم به صورت دقیق اثربخشی دارو (Drug Efficacy) را علیه عوامل بیماریزا ثبت کنیم.
سازمان غذا و دارو (FDA) برای واکسنها و داروهای عفونتزا، دادههای مطالعات حیوانی را الزامی میداند.
۴. مدلهای متابولیک (Metabolic Animal Models)
این مدلها برای بررسی داروهای دیابت، چاقی، کبد چرب و بیماریهای مزمن ضروری هستند.
پارامترهای کلیدی:
- HbA1c
- انسولین
- ALT, AST
- شاخص چربی خون
در این مدلها، ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) پایه تصمیمگیری درباره ورود دارو به فاز انسانی است.
۵. مدلهای درد (Pain Models)
این بخش در آزمایشهای حیوانی (Animal Testing) برای ارزیابی مسکنها، ضدالتهابها، داروهای نوروپاتیک و محصولات ارتوپدی استفاده میشود.
این مدلها در مراحل پیشبالینی (Preclinical) برای مستندسازی اثر ضروری هستند.
۶. مدلهای بازسازی و ترمیم بافت (Regeneration Models)
ویژه داروهای ترمیم زخم، پوست، غضروف، استخوان و محصولات سلولی.
این مدلها، نمونهای دقیق از یک مسیر طبیعی برای ثبت اثر در سطح بافت هستند و دادههای آن برای تأییدیه سازمان غذا و دارو
(FDA Approval) اهمیت زیادی دارد.
۷. مدلهای قلبی– عروقی (Cardiovascular Animal Models)
این مدلها به شکل تخصصی در داروهای فشار خون، ضدآریتمی و محافظ قلب استفاده میشوند.
در این مدلها، دادههای اثربخشی دارو (Drug Efficacy) باید دقیق، کمی و استاندارد باشد تا برای سازمان غذا و دارو (FDA) قابل قبول باشد.
روشهای اندازهگیری اثربخشی دارو (Drug Efficacy Measurement Methods)
تمام این روشها باید در مرحله پیشبالینی (Preclinical) انجام شود.
۱. تصویربرداری پیشرفته (IVIS, MRI, PET)
برای تحلیل دینامیک دارو، توزیع بافتی و پاسخ درمانی.
این تکنیکها در تمام مسیر ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) الزامی هستند.
۲. بیوشیمی و خون
ALT، AST، HbA1c و مارکرهای التهابی برای تأیید اثربخشی دارو (Drug Efficacy) مهماند.
۳. هیستوپاتولوژی (Histopathology)
تحلیل بافت پس از درمان — پایه تأییدیه سازمان غذا و دارو (FDA).
۴. ایمنوهیستوشیمی و بیان ژن
برای تعیین اثر دارو در سطح مولکولی.
۵. تستهای رفتاری (Behavioral Analysis)
استاندارد طلایی برای داروهای سیستم عصبی مرکزی.
طراحی پروتکل کامل پیشبالینی (Preclinical Protocol Design)
در Vision of Research و Histogenotech، پروتکل پیشبالینی شامل:
- انتخاب مدل حیوانی (Animal Model Selection)
- طراحی مسیر دوزدهی
- اجرای کامل آزمایشهای حیوانی (Animal Testing)
- تحلیل آماری
- استخراج دادههای اثربخشی دارو (Drug Efficacy)
- نگارش گزارش رسمی
- آمادهسازی مدارک برای تأییدیه سازمان غذا و دارو (FDA Approval)
نقش سازمان غذا و دارو (FDA) در مسیر پیشبالینی (Preclinical Track)
در صنعت دارو، هیچ مرحلهای به اندازه ارتباط مستقیم مطالعات پیشبالینی (Preclinical) با سازمان غذا و دارو (FDA) سرنوشتساز نیست. تمام دادههایی که در مرحله آزمایشهای حیوانی (Animal Testing) جمعآوری میشود باید در قالب یک ساختار استاندارد برای ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) آماده گردد تا نشان دهد داروی جدید ارزش ورود به بدن انسان را دارد.
سازمان غذا و دارو (FDA) در تمام دنیا بهعنوان معتبرترین مرجع اعلام کرده:
بدون شواهد کافی پیشبالینی (Preclinical Evidence)، هیچ دارویی حق ورود به فاز انسانی را ندارد.
این یعنی هر شرکت یا پژوهشگاه جدی که به دنبال بازار امارات، اروپا، آمریکا یا GCC است، ناچار است یک مسیر استاندارد برای اثربخشی دارو (Drug Efficacy) فراهم کند.
رابطه اثربخشی دارو (Drug Efficacy) و تأییدیه سازمان غذا و دارو (FDA Approval)
هر پروندهای که برای دریافت تأییدیه سازمان غذا و دارو (FDA Approval) ارسال میشود شامل یک فصل بزرگ به نام:
Preclinical Efficacy Section یا Nonclinical Efficacy Package
در این بخش دادههای زیر وجود دارد:
- مدلهای حیوانی (Animal Models)
- نتایج کامل آزمایشهای حیوانی (Animal Testing)
- جداول و نمودارهای اثربخشی دارو (Drug Efficacy)
- تحلیلهای آماری
- دادههای هیستوپاتولوژی
- شواهد مولکولی
- تحلیل خطر (Risk Assessment)
- ارزیابی اثربخشی دارو (Drug Efficacy Evaluation)
بهطور خاص، FDA در بررسی مدلهای حیوانی به سه چیز اهمیت میدهد:
۱. تکرارپذیری (Repeatability)
دادههای اثربخشی باید قابل تکرار باشند.
۲. شفافیت (Transparency)
تمام متدهای آزمایشهای حیوانی باید واضح باشد.
۳. ارتباط با انسان (Human Translation)
آیا نتایج پیشبالینی قابل انتقال به انسان هست یا نه؟
این سه اصل تعیین میکند که یک دارو FDA Approval میگیرد یا رد میشود.
ساختار پرونده پیشبالینی (Preclinical Dossier Structure)
برای دریافت تأییدیه سازمان غذا و دارو (FDA Approval)، شرکتها باید یک پرونده کامل شامل:
- مطالعات پیشبالینی (Preclinical Studies)
- اثربخشی دارو (Drug Efficacy)
- ارزیابی اثربخشی دارو (Drug Efficacy Evaluation)
- آزمایشهای حیوانی (Animal Testing)
- دادههای GLP
- ماژول کامل CTD
را سابمیت کنند.
بخش گسترده: اثربخشی دارو (Drug Efficacy) در مدلهای حیوانی
۱. اهمیت اثربخشی دارو (Drug Efficacy)
اثربخشی دارو در مرحله پیشبالینی (Preclinical) تعیین میکند آیا یک دارو ارزش سرمایهگذاری دارد یا نه.
اگر نتایج اثربخشی ضعیف باشد:
- وارد فاز انسانی نمیشود
- هزینهها از بین میرود
- پروژه رد میشود
- FDA Approval غیرممکن میشود
پس قدرت واقعی یک دارو در همین مرحله مشخص میشود.
۲. معیارهای اندازهگیری اثربخشی دارو (Drug Efficacy Measurement)
در مدلهای حیوانی، اثربخشی دارو بر اساس:
- تغییرات بیوشیمیایی
- نتایج رفتاری
- تغییرات توموری
- بهبود متابولیک
- کاهش التهاب
- زندهمانی (Survival)
- مسیرهای مولکولی
اندازهگیری میشود.
تمام این دادهها وارد بخش Drug Efficacy Evaluation پرونده FDA میشود.
۳. نقش حیوان در اثبات اثر (Animal Testing Role)
بدون مدل حیوانی هیچ داده قطعی وجود ندارد. Human Trials به دادههای Animal Testing متکیاند.
بنابراین:
- اثربخشی دارو
- ایمنی اولیه
- مکانیسم اثر
- منحنی دوز
همه در حیوان مشخص میشود.
۴. مستندسازی اثربخشی دارو برای FDA
یکی از بزرگترین اشتباههای شرکتها این است که فقط داده خام تولید میکنند.
اما برای تأییدیه سازمان غذا و دارو (FDA Approval) باید:
- جدولها
- نمودارها
- نتایج کمی
- تحلیل آماری
- توضیح ارتباط انسانی
- توجیه انتخاب مدل حیوانی
همه مستند شود.
بدون اینها، FDA پرونده را Reject میکند.
مکانیسمهای اثربخشی دارو (Drug Efficacy Mechanisms)
در مرحله پیشبالینی (Preclinical) و با استفاده از آزمایشهای حیوانی (Animal Testing)
برای اینکه یک داروی جدید بتواند در مرحله پیشبالینی (Preclinical) بهطور معتبر و قابل قبول برای سازمان غذا و دارو (FDA) ارزیابی شود، باید مکانیسم اثر آن در مدلهای حیوانی (Animal Models) مشخص باشد.
این کار بخشی از فرآیند ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) است و تعیین میکند دارو چگونه و از چه مسیرهایی عمل میکند.
مکانیسمهای اصلی اثربخشی دارو شامل:
۱. اثرات سلولی (Cellular Mechanisms)
در مدلهای حیوانی، اولین سطح تحلیل، سلولها هستند.
دادههای سلولی، پایهای برای اثربخشی دارو (Drug Efficacy) محسوب میشوند.
نمونهها:
- تغییر بیان ژن
- فعالسازی مسیرهای سیگنالینگ
- کاهش مارکرهای التهاب
- مهار تکثیر سلولی
این اطلاعات در گزارشهای پیشبالینی (Preclinical Reports) بهعنوان بخش مهم پرونده
تأییدیه سازمان غذا و دارو (FDA Approval) درج میشوند.
۲. اثرات بافتی (Tissue-Level Mechanisms)
در بسیاری از داروها، بهویژه ضدالتهابها، آنتیکانسرها و محصولات ترمیم بافت، تغییرات در سطح بافتی مهمتر از سطح سلولی است.
این شامل:
- بهبود ساختار بافت
- کاهش نکروز
- کاهش فیبروز
- بهبود عروق تغذیهای (angiogenesis)
این تحلیلها از آزمایشهای حیوانی (Animal Testing) حاصل میشود و در تمام پروندههای ارزیابی اثربخشی
دارو (Drug Efficacy Evaluation) اهمیت اساسی دارد.
۳. مکانیسمهای مولکولی (Molecular Mechanisms)
در مطالعات پیشبالینی (Preclinical)، باید مشخص شود دارو:
- کدام ژن را هدف میگیرد
- چه مسیر مولکولی را مهار یا فعال میکند
- چه پروتئینهایی را کاهش یا افزایش میدهد
و این اطلاعات بهصورت مستقیم وارد فصل مکانیسم اثر در پروندهFDA میشود.
۴. مکانیسمهای رفتاری (Behavioral Mechanisms)
در مدلهای درد، مدلهای نورولوژی، مدلهای اضطراب و افسردگی، رفتار حیوان است که اثربخشی دارو (Drug Efficacy) را ثابت میکند.
این دادهها در مرحله ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) بسیار مهماند، چون:
- کمی هستند
- قابل تکرار هستند
- قابل تحلیل آماری هستند
و بهطور مستقیم توسط سازمان غذا و دارو (FDA) بررسی میشوند.
۵. مکانیسمهای ایمنی و التهابی (Immune & Inflammatory Mechanisms)
در داروهای سیستم ایمنی، واکسنها و ضدالتهابها، واکنش ایمنی حیوان نقش اصلی دارد.
پارامترها شامل:
- سطح سیتوکینها
- پاسخ آنتیبادی
- سطح CRP
- میزان اینترلوکینها
که پایه واقعی اثربخشی دارو (Drug Efficacy) در حوزههای ایمونولوژی هستند.
این دادهها برای تأییدیه سازمان غذا و دارو (FDA Approval) کاملاً ضروریاند.
ارتباط مکانیسمها با تصمیمهای FDA
سازمان غذا و دارو (FDA) فقط با دیدن نتایج کلی تصمیم نمیگیرد.
بلکه ساختار تصمیمگیری آن بر اساس ۴ ستون است:
۱. قدرت مطالعات پیشبالینی (Preclinical Strength)
- عدد حیوانات
- روششناسی
- کنترلها
- تحلیل داده
۲. وضوح آزمایشهای حیوانی (Animal Testing Transparency)
شرح دقیق همه مراحل.
۳. قدرت اثربخشی دارو (Drug Efficacy Strength)
اگر مکانیسم اثر قوی نباشد، دارو رد میشود.
۴. کیفیت ارزیابی اثربخشی دارو (Drug Efficacy Evaluation Quality)
اگر دادهها ناقص یا غیرعلمی باشند، پرونده رد میشود. پس همه چیز باید کامل، شفاف، مستند و علمی باشد.
تحلیل دادهها (Data Analysis)
بخشی حیاتی از مطالعات پیشبالینی (Preclinical)
در مرکز Vision of Research و Histogenotech، تحلیل دادههای زیستی و روشهای آنالیز آماری شامل:
- آنالیز واریانس (ANOVA)
- مدلهای رگرسیون (Regression Models)
- منحنیهای پاسخ به دوز (Dose-Response Curves)
- آنالیز بقای کاپلان مایر (Kaplan-Meier Survival)
- نمرهدهی هیستوپاتولوژیک (Histological Scoring)
این تحلیلها امکان تفسیر واقعی اثربخشی دارو (Drug Efficacy) را فراهم میکنند و پایه رسمی ارزیابی اثربخشی
دارو (Drug Efficacy Evaluation) هستند. تمام این نتایج برای ارسال به سازمان غذا و دارو (FDA) قالببندی میشوند.
تنظیم گزارش رسمی برای FDA Approval
این مرحله شامل:
- خلاصهسازی مطالعات پیشبالینی
- گزارش کامل مدلهای حیوانی
- دادههای خام و تمیز
- نمودارهای اثربخشی
- تصاویر هیستوپاتولوژی
- تحلیل دقیق
- بحث علمی
- بخش “Justification” برای انتخاب مدلها
- بخش “Human Relevance”
تمام اینها در پرونده نهایی جهت دریافت، تأییدیه سازمان غذا و دارو (FDA Approval)ارائه میشود.
تحلیل نهایی اثربخشی دارو (Drug Efficacy Final Discussion)
در پایان مطالعات پیشبالینی (Preclinical Studies) و پس از اجرای کامل آزمایشهای حیوانی (Animal Testing)، مهمترین مرحله، تحلیل نهایی و ارائهی یک جمعبندی دقیق از اثربخشی دارو (Drug Efficacy) است. این جمعبندی باید بهصورت علمی، شفاف، و قابل ارائه به سازمان غذا و دارو (FDA) باشد.
در این مرحله مجموعهای از سوالات کلیدی مطرح میشود:
۱. آیا دارو در مدلهای حیوانی اثربخشی کافی داشته است؟
دادههای حاصل از ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) باید نشان دهند که دارو نه تنها اثر دارد، بلکه اثر آن از نظر بالینی معنیدار است.
۲. آیا این اثربخشی قابل انتقال به انسان است؟ (Clinical Translation)
FDA بهطور خاص روی این موضوع حساس است.
در مرحله پیشبالینی (Preclinical) باید توضیح داده شود:
- چرا مدل حیوانی انتخاب شد
- چگونه این مدل رفتار انسانی را تقلید میکند
- چرا دادههای اثربخشی دارو (Drug Efficacy) در این حیوانها برای انسان معتبر است
بدون این توضیح، تأییدیه سازمان غذا و دارو (FDA Approval) بههیچ عنوان صادر نمیشود.
۳. آیا مکانیسم اثر دارو واضح است؟
در گزارش باید مشخص باشد که:
- دارو چگونه اثر میکند
- کدام مسیر مولکولی فعال یا مهار میشود
- آیا مکانیسم اثر با نتایج حیوانی همخوانی دارد
این بخش یکی از ستونهای اصلی پرونده FDA است.
۴. آیا دوز مناسب در حیوان انتخاب شده؟
سازمانFDA به منحنی دوز پاسخ اهمیت بسیار زیادی میدهد.
دوز اشتباه = اثربخشی اشتباه = رد شدن Approval یا عدم دریافت مجوز
۵. آیا دادهها قابل تکرار و معتبر هستند؟
این معیار طلایی FDA است.
اگر یک مطالعه پیشبالینی (Preclinical) بهطور علمی طراحی نشده باشد، حتی اگر نتایج خوب باشد، FDA آن را قبول نمیکند.
تبدیل نتایج پیشبالینی به نتایج انسانی (Clinical Translation)
پس از پایان مطالعات حیوانی، باید یک مسیر منطقی و علمی برای انتقال نتایج به فاز انسانی ارائه شود:
این مسیر شامل موارد زیر است:
- توضیح نقش گونه حیوانی
- مقایسه فیزیولوژی حیوان با انسان
- تحلیل خطر برای انسان
- تعیین Starting Dose انسانی (Human Initial Dose)
- ارتباط منطقی بین اثربخشی دارو (Drug Efficacy) در حیوان و انسان
این بخش یکی از مهمترین قسمتهای ارزیابی اثربخشی دارو (Drug Efficacy Evaluation) است.
آمادهسازی برای ارسال به FDA
فصل پیشبالینی (Preclinical Module)
در پرونده CTD برای دریافت تأییدیه سازمان غذا و دارو (FDA Approval)، بخش پیشبالینی شامل:
- مطالعات in vivo
- مطالعات in vitro
- مدلهای حیوانی (Animal Models)
- آزمایشهای حیوانی (Animal Testing)
- نمودارهای اثربخشی
- نتایج بیوشیمی
- تصاویر هیستولوژی
- گزارشهای رفتاری
- تحلیل دادهها
- بحث علمی
- Human Relevance
- Justification of Model
هر خط این قسمت باید دقیق باشد. ما در Vision of Research و Histogenotech این بخش را با استاندارد کامل ارائه میکنیم.
جمعبندی نهایی (Final Conclusion)
پیشبالینی + حیوان + اثربخشی + FDA = مسیر واقعی موفقیت
در نهایت، موفقیت توسعه یک دارو به این چهار عامل وابسته است:
- ✔ مطالعات پیشبالینی (Preclinical Studies)
- ✔ آزمایشهای حیوانی (Animal Testing)
- ✔ اثربخشی دارو (Drug Efficacy)
- ✔ تأییدیه سازمان غذا و دارو (FDA Approval)
اگر هرکدام ناقص باشد، مسیر دارو به فاز انسانی بسته میشود.
اما اگر این چهار ستون کامل و حرفهای اجرا شوند، دارو:
- شانس ورود به بازار جهانی دارد
- امکان دریافت فاند و گرنت بالا دارد
- قابل ثبت در اروپا، امارات، عربستان، عمان و آمریکا است
- بهطور مستقیم در مسیر توسعه جهانی قرار میگیرد
سوالات متداول (FAQ)
۱. چرا مطالعات پیشبالینی (Preclinical Studies) ضروری هستند؟
چون بدون مرحله پیشبالینی، FDA اجازه ورود به فاز انسانی نمیدهد.
۲. چرا آزمایشهای حیوانی (Animal Testing) لازم هستند؟
تنها روش مطمئن برای سنجش رفتار دارو در بدن زندهاند.
۳. آیا اثربخشی دارو (Drug Efficacy) فقط در حیوان مهم است؟
خیر، اما حیوان پایهایترین مرحله برای پیشبینی عملکرد انسانی است.
۴. چه عاملی باعث رد شدن FDA Approval میشود؟
ضعف در ارزیابی اثربخشی دارو، طراحی بد مدل حیوانی، یا دادههای ناقص.
۵. آیا Vision of Research/HGT گزارش مورد نیاز FDA را تولید میکند؟
بله، بهصورت کامل و قابل سابمیت رسمی.
اگر قصد توسعه یک داروی جدید، یک محصول بیوتکنولوژی یا یک فرمولاسیون درمانی را دارید، شرکت دانش بنیان هیستوژنوتک و همچنین شعبه آن در امارات به نام Vision of Research ،
کاملترین مسیر پیشبالینی (Preclinical)
استانداردترین آزمایشهای حیوانی (Animal Testing)
تحلیل دقیق اثربخشی دارو (Drug Efficacy)
و گزارش کامل برای تأییدیه سازمان غذا و دارو (FDA Approval) را ارائه میدهند.
همهچیز از طراحی تا گزارش، در یک مرکز، بدون اتلاف زمان.