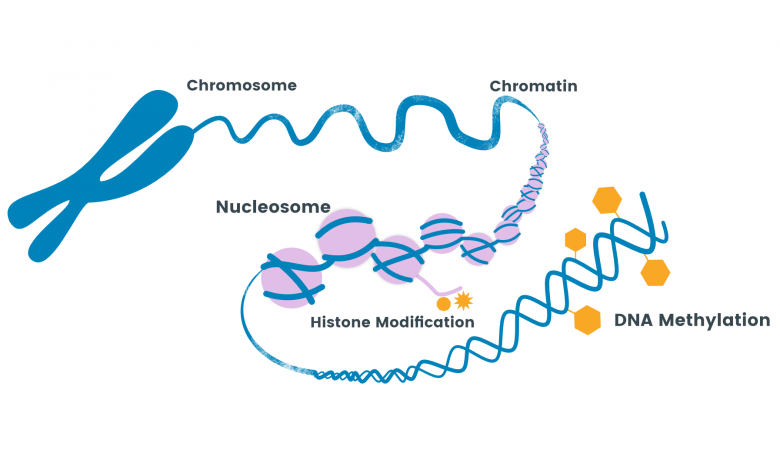
متیلاسیون DNA اولین تغییر اپیژنتیکی شناخته شده در سلولهای پستانداران است. متیلاسیون DNA به تغییرات برگشت پذیر و قابل وراثت در بیان ژنها بدون تغییر در توالی DNA اطلاق میشود. این تغییرات، شامل متیلاسیون DNA و تغییرات پس از ترجمه هیستونها، تحت تاثیر عوامل محیطی قرار دارند و پل ارتباطی بین محیط و ژنوم محسوب میشوند.
فرآیند متیلاسیون DNA
در پستانداران متیلاسیون DNA در کربن شماره ۵ سیتوزین در بستر دی نوکلئوتید CpG و توسط آنزیمهای DNA متیل ترانسفراز رخ میدهد. در ژنوم این موجودات، نواحی غنی از CpG در بسیاری از پروموترها دیده میشوند و جزایر CpG را تشکیل میدهند. متیلاسیون این جزایر میتواند با ممانعت از دسترسی عوامل رونویسی به پروموتر یا فراخوانی پروتئینهای متصل شونده به CpG های متیله بیان ژن را سرکوب کند. پروتئینهای متصل شونده به CpGهای متیله با فراخوانی کمپلکسهای حاوی هیستون دِاستیلازها، باعث دِاستیلاسیون پروتئینهای متصل شونده به بازماندههای لیزین هیستونها و بسته شدن ساختار کروماتین و در نتیجه خاموشی رونویسی میشوند.
نقش ها و عملکرد های متیلاسیون DNA
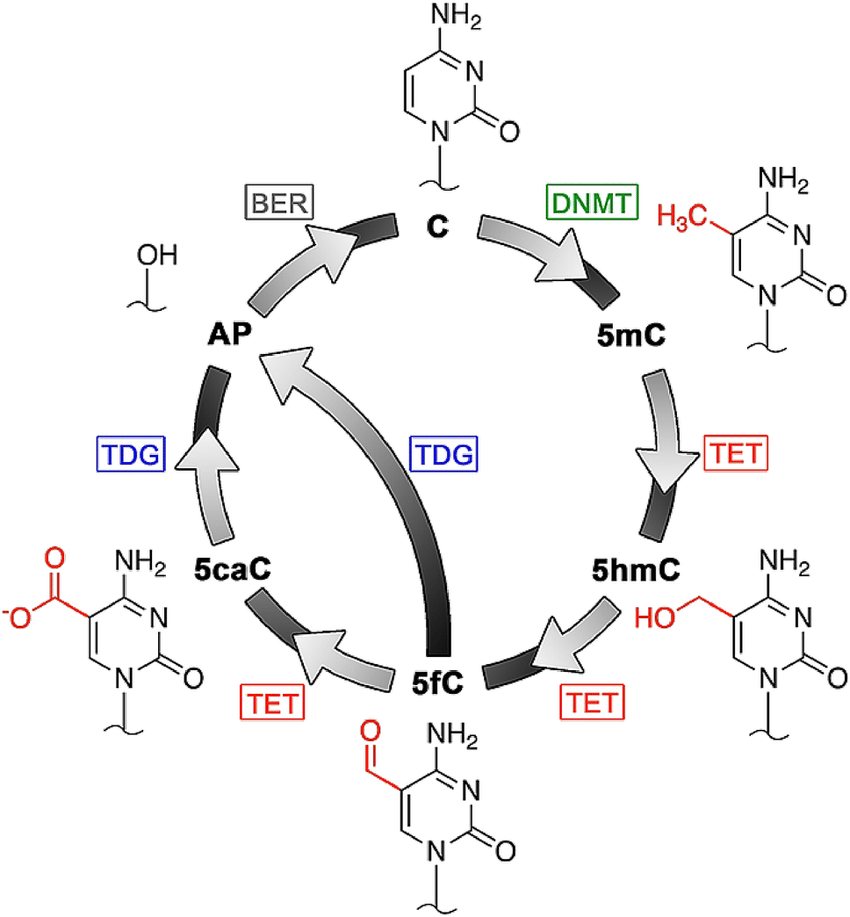
متیلاسیون DNA به عنوان یک سیستم اپی ژنتیکی در تکوین جانداران، غیرفعال شدن یکی از کروموزوم های X در پستانداران ماده، حافظه سلولی، نقش بندی بیان RNA های غیر کد کننده، مهار ژنی و مقابله با سرطان نقش دارد.
در این روشها ابتدا DNA در معرض آنزیمهای محدود کننده قرار می گیرد و سپس توسط PCR تکثیر میشود. معمولا این روش برای مطالعه DNA با درصد بالای متیلاسیون استفاده میشود. روشهای دیگر که امروزه بسیار رایج هستند، روشهایی مبتنی بر تغییرات شیمیایی با سدیم بیسولفیت و تعیین توالی ژنوم پس از تیمار با بیسولفیت میباشند. اساس عملکرد تکنیکهایی که پایهی آنها تغییرات بیوشیمیایی توسط بیسولفیت است به این صورت است که سیتوزینهایی که غیرمتیله هستند به یوراسیل تبدیل میشوند ولی بر روی سیتوزینهای متیله عملکردی ندارد. بنابراین بی سولفیت بسته به حضور یا عدم حضور متیل روی سیتوزین تغییرات ویژهای را در DNA ایجاد میکند که با روشهای PCR، توالییابی و ریزآرایه قابل ارزیابی است. روشهای دیگری وجود دارد که مبتنی بر تمایل آنتیبادی علیه DNA متیله یا پروتئینهای متصل شونده به آن برای مشخص کردن متیلاسیون است.
مطالب مرتبط: نقش میکرو RNA ها در مهار سرطان
به طور کلی چند روش اصلی در روند بررسی متیلاسیون وجود دارد:
- روشهای مبتنی بر برش توسط آنزیمهای محدود کننده حساس به متیلاسیون
- روش های مبتنی بر تیمار با بیسولفیت سدیم
- روشهای مبتنی بر استفاده از آنتی بادی
روش مبتنی بر تیمار با بیسولفیت
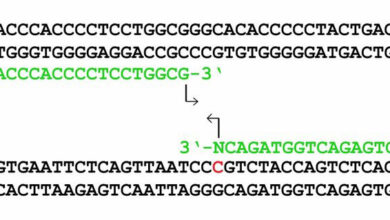
تیمار با بیسولفیت DNA یکی از راج ترین تکنیک ها در این زمینه می باشد که در این روش ابتدا DNA با بیسولفیت تیمار میشود تا سیتوزینهای غیرمتیله به یوراسیل تبدیل شود که در PCR با تیمین جایگزین خواهد شد. پرایمرها برای خارج از نواحی که CpG داخل آن است طراحی میشود و معمولا صرف نظر از جایگاه متیلاسیون توالی هدف را میسازد یا می توان مانند روش واکنش زنجیره ای پلیمراز خاص متیلاسیون، دو جفت پرایمر ویژه برای نواحی CpG متیله و غیرمتیله طراحی کرد. توالییابی بیسولفیت ارزیابی دقیقتری از جایگاه متیلاسیون در مقایسه با روش PCR که در آن برای توالی متیله و غیرمتیله پرایمر طراحی میشود را ارائه میدهد و در نهایت محصولات حاصل از PCR برای توالییابی استفاده خواهد شد.
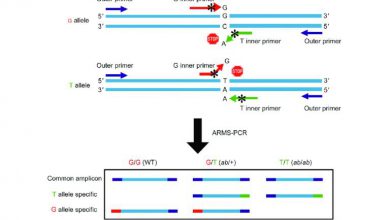
روش هایی که بر اساس تکثیر DNA بیسولفیته شده با PCR میباشند میتوانند بر اساس پرایمرهای PCR به دو گروه تقسیم شوند: یک گروه پرایمرهایی که به طور اختصاصی الگوهای متیله یا غیرمتیله را تکثیر میکنند به عنوان مثال واکنش زنجیرهای پلیمراز خاص متیلاسیون و گروه دوم پرایمرهایی که صرف نظر از وضعیت متیلاسیون جهت آنالیز متیلاسیون بعد از PCR به DNA الگو اجازه تکثیر میدهند و شامل ذوب با تفکیک بالا[۲]، هضم با آنزیم[۳] و توالییابی پس از تیمار با بیسولفیت میباشند.
آنالیز ترکیبی برش توسط آنزیمهای محدود کننده و بی سولفیت
این روش ترکیبی از تیمار با بیسولفیت، PCR و آنزیم محدود کننده است و برای بررسی متیلاسیون در یک جایگاه خاص استفاده میشود. ابتدا DNA با بیسولفیت تیمار میشود و با پرایمرهایی که برای BSP طراحی شده است قطعه مورد نظر تکثیر میشود. محصول با آنزیم محدود کننده تیمار میشود با توجه به تغییر سیتوزینهای غیرمتیله به تیمین ممکن است جایگاههای برش آنزیم تغییر پیدا کرده باشد و نتواند DNA را هضم کند در نتیجه الگوی باندهای الکتروفورز آن نسبت به نمونهی متیله شده متفاوت است. از معایب این روش این است که فقط سیتوزینها در جایگاه شناسایی آنزیمها تشخیص داده میشوند ولی این روش کمّی و آسان بوده که برای مقادیر DNA اولیه کم و نمونههای فیکس شده با پارافین نیز قابل استفاده است.
متیلاسیون DNA و بررسی طول تلومر
بررسی تغییرات اپی ژنتیک به ویژه متیلاسیون و فسفریلاسیون برای نواحی خاصی از ژنوم از جمله تلومر بسیار حائز اهمیت می باشد. تلومرها ساختارهای نوکلئوپروتئینی هستند که انتهای کروموزوم ها را پوشش می دهند. یکپارچگی ساختار تلومر و هگزامر DNA آن (TTAGGG) n یک توالی تکراری مهم برای محافظت از انتهای کروموزوم ها در برابر تخریب و در حفظ ثبات کلی ژنوم حیاتی است.
تعداد هگزامر DNA (TTAGGG) n تکرار در طول هر تقسیم سلولی در سلول های تمایز یافته کاهش می یابد، و در نتیجه طول تلومر اغلب در اکثر سلول های تمایز یافته در طول عمر ارگانیسم کاهش می یابد. کوتاه شدن تلومرها میتواند منجر به همجوشی انتهای تلومر و افزایش سطح بیثباتی کروموزوم شود که به نوبه خود یک رویداد آغازگر کلیدی در بسیاری از سرطانها از جمله سرطان ریه، سینه، کولون و پروستات است.
مطالعات نشان داده است که کوتاه شدن تلومر می تواند توسط عوامل محیطی مانند استرس روانی و فیزیولوژیکی، استعمال سیگار و چاقی تسریع شود. به همین دلیل بررسی طول تلومر در جهت ارزیابی بسیاری از مخاطرات پیش رو و روند افزایش سن بسیار حائز اهمیت می باشد. یکی از روش های رایج در این مسیر بررسی عملکرد آنزیم تلومراز است که مانع از کوتاهی انتهای کوروموزوم شده و در سلول های سرطانی بیشتر عملکرد دارد.
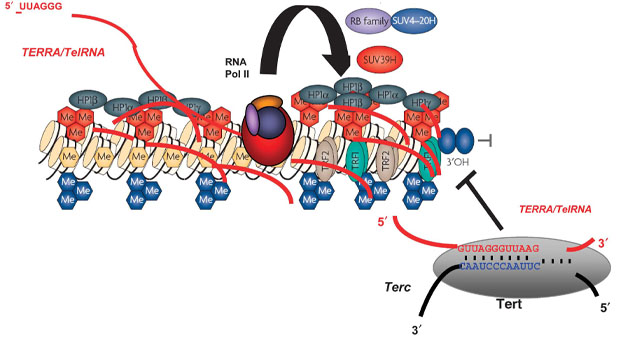
برای بررسی این آنزیم می توان سنجش میزان TERT فسفریله را انجام داد که در فرم فسفریله منجر به مهار تلومراز می شود. از طرفی دو پروتئین TRF1 و TRF2 توسط انتهای کربوکسیل خود به DNA تلومری متصل می شوند و برای عمل طبیعی ناحیه تلومری ضروری هستند. بررسی بیان هر یک از این ژن ها می تواند گزینه مناسبی برای بررسی طول تلومر باشد. جهت اندازه گیری طول تلومر، از واکنش Real time PCR،برای سنجش فعالیت آنزیم تلومراز، از روش (Telomerase Repeated Amplification Protocol (TRAP می توان استفاده نمود. در بررسی طول تلومر با استفاده از Real time PCR می توان میزان تعداد کپی های پرایمر اختصاصی تلومر را با استفاده از پرایمر اختصاصی tel و یک پرایمر تک کپی مورد مقایسه قرار داد.
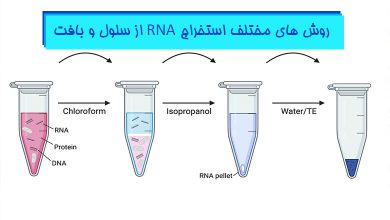
مطالب مرتبط: اصول واکنش زنجیره ای پلیمراز (PCR) – روش های مختلف استخراج RNA از سلول و بافت
خدمات مرتبط: استخراج RNA و DNA سنتز cDNA ، طراحی پرایمر ، انجام تکنیک PCR و Real time PCR