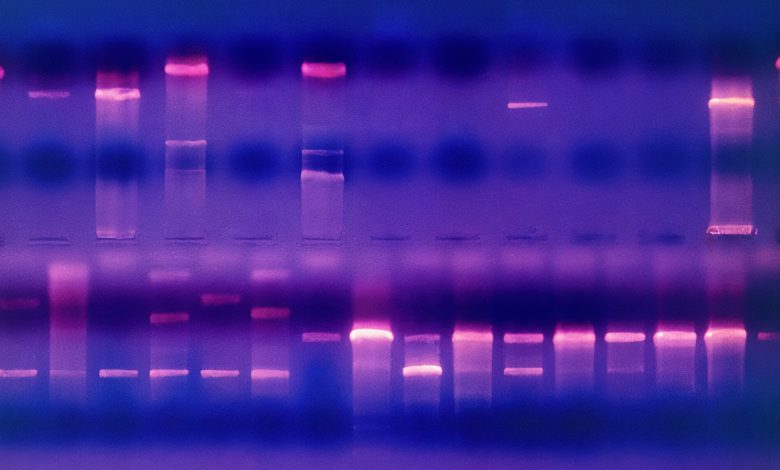
تکنیک ژل الکتروفورز، تکنیکی قدیمی اما بسیار کاربردی است که برای جداسازی ماکرومولکول های سلولی باردار در یک میدان الکتریکی استفاده می گردد. تاریخچه استفاده موفقیت آمیز از روش الکتروفورز جهت جداسازی مولکول های زیستی مختلف به دهه ۱۹۶۰ بر می گردد و از همان زمان از اهمیت فوق العاده ای در مطالعات DNA و RNA و جداسازی آن ها برخوردار شد.
اساس تکنیک ژل الکتروفورز و انواع نمونه های مورد بررسی
انواع مختلفی از روش الکتروفورز وجود دارد که در متداول ترین آن ها، جداسازی مولکول های زیستی شامل DNA و RNA که دارای بار منفی هستند براساس اندازه یا سایز مولکولی آن ها صورت می گیرد.
در مورد پروتئین ها نیز جداسازی بر اساس سایز در حالتی که پروتئین ها با ترکیب سدیم دودسیل سولفات (SDS) با بار منفی پوشیده شده باشند صورت می گیرد. در این روش، بیومولکول ها در یک میدان الکتریکی قرار می گیرند که جریان الکتریکی آن از قطب منفی به سمت قطب مثبت برقرار می شود.
نمونه های دارای بار منفی در طی الکتروفورز از قطب منفی دور شده و به سمت قطب مثبت حرکت می کنند و براساس اندازه مولکولی خود از یکدیگر جدا می شوند. به این صورت که نمونه های با سایز بزرگتر کندتر و نمونه هایی با سایز کوچکتر سریع تر حرکت کرده و بدین ترتیب نمونه هایی با اندازه های مختلف از یکدیگر جدا می شوند.

ژل الکتروفورز
در تکنیک ژل الکتروفورز، بستر یا ماتریکسی به منظور بارگذاری و حرکت نمونه ها در میدان الکتریکی مورد نیاز است که از پلی ساکاریدی به نام آگارز استفاده می شود.
انتخاب ماتریکس مناسب برای انجام الکتروفورز به نوع نمونه و اندازه آن بستگی دارد. به این صورت که برای جداسازی پروتئین ها و قطعات DNA با سایز بسیار کوچک از ژل پلی اکریلامید استفاده می شود؛ در حالیکه برای جداسازی قطعات بزرگتر DNA و نیز RNA از ژل آگارز به کار می رود.
پس از انجام الکتروفورز، ژل حاوی نمونه های ران شده با استفاده از رنگ های مخصوص رنگ آمیزی اسیدهای نوکلئیک نظیر اتیدیوم برماید رنگ آمیزی شده و در نهایت قطعات مورد نظر بر روی ژل با استفاده از یک دستگاه مجهز به منبع نور فرابنفش (UV) (Gel Doc) قابل مشاهده خواهد بود.
ترکیبات مورد استفاده به عنوان ماتریکس یا ژل الکتروفورز نظیر آگارز و پلی اکریلامید این قابلیت را دارند که پس از قرارگیری در شرایط بافری و دمایی مناسب، ساختارهای سه بعدی متخلخلی را تشکیل می دهند. بسته به درصد وزنی تهیه شده از آن ها، این ژل ها دارای منافذی با سایزهای کوچک تا بزرگ (درصد کم تا زیاد) می باشند که امکان عبور بیومولکول ها از درون آن ها را فراهم می کنند. برای مثال، ژل آگارز یک درصد دارای منافذی با اندازه ۱۰۰ تا ۵۰۰ نانومتر می باشد. با افزایش دما، پیوندهای هیدروژنی بین مولکول های ژل از هم گسسته شده و ژل به حالت مایع تبدیل می گردد. دمای ذوب ژل آگارز بین ۸۵ تا ۹۵ درجه سانتی گراد می باشد.

کاربردهای تکنیک الکتروفورز بر روی ژل آگارز
تکنیک ژل الکتروفورز، یک روش کیفی جهت شناسایی و بررسی نمونه های حاصل از استخراج، محصولات PCR و محصولات هضم آنزیمی استفاده می شود.
روش الکتروفورز بر روی ژل آگارز در عین سادگی می تواند مانند سایر روش های آزمایشگاهی با چالش هایی همراه باشد و نتیجه دلخواهی از آن حاصل نگردد. برخی از این مشکلات به دلیل عدم رعایت اصول مربوط به روش الکتروفورز و برخی مربوط به نمونه های مورد نظر می باشد.
نکات ضروری تکنیک ژل الکتروفورز
- استفاده از بافر مناسب (TAE 1% یا TBE 0.5%) برای تهیه ژل آگارز و همچنین برای پر کردن تانک الکتروفورز (دقت شود بافر مورد استفاده برای تانک و تهیه ژل باید یکسان باشند)
- استفاده از پودر آگارز با کیفیت مطلوب
- انتخاب ولتاژ و جریان مناسب بسته به نوع نمونه (ولتاژ دستگاه بایستی براساس فاصله بین دو قطب آند و کاتد تانک انتخاب شود که به طور استاندارد معمولا ۵ ولت به ازای هر سانتی متر فاصله دو قطب تانک می باشد)
- استفاده از بافر تازه و استفاده نشده جهت تهیه ژل آگارز
- تهیه ژل آگارز با درصد متناسب با سایز نمونه ها ( ۸/۰ درصد برای پلاسمیدها، ۱ درصد برای محصولات PCR بزرگتر از ۱۰۰ جفت باز و ژل ۲ درصد برای RNA و محصولات PCR کوچکتر از ۱۰۰ جفت باز)
- استفاده از بافر تمیز و ترجیحا نو برای پر کردن تانک الکتروفورز ( بافرهای تانک برای چندین بار قابل استفاده هستند اما بهتر است جهت حصول نتیجه بهتر از بافرهای کهنه و استفاده شده به دفعات زیاد استفاده نشود).
در برخی موارد عدم حصول نتیجه مورد انتظار از روش الکتروفورز به دلیل کیفیت نامطلوب نمونه های مورد بررسی می باشد. بسته به نوع نمونه مورد نظر ران شده بر روی ژل الکتروفورز نتایج مختلفی حاصل می گردد که در زیر به برخی مشکلات مربوط به سه نوع نمونه پرکاربرد یعنی محصول PCR، RNA و پلاسمیدها اشاره می گردد:
الکتروفورز محصولات PCR
پس از انجام الکتروفورز محصولات PCR انتظار می رود که باندهای مورد نظر با سایز صحیح در جایگاه درست نسبت به سایز مارکر مورد استفاده قرار گیرند و باند غیر اختصاصی یا باند مربوط به پرایمر دایمر مشاهده نشود.
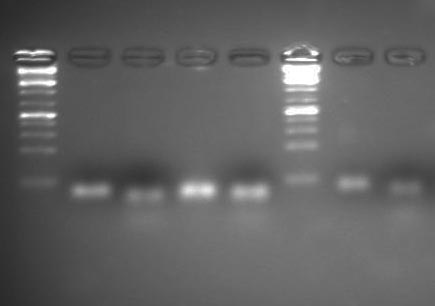
| مشکل | علت | راه حل |
| عدم مشاهده باند | عدم اتصال پرایمر به محل مورد نظر بر روی الگو، اختصاصی نبودن پرایمرها، ست آپ نبودن میزان هر یک از اجزای PCR و یا برنامه دمایی، غلظت پایین نمونه الگو | طراحی پرایمر اختصاصی، تهیه میکسی از غلظت های مناسب تمامی اجزای PCR، انجام PCR گرادیانت دمایی جهت پیدا کردن دمای مناسب اتصال پرایمر به الگو، استفاده از غلظت کافی از نمونه الگو |
| مشاهده اسمیر | غلظت بالای DNA الگو، تکثیر غیر اختصاصی قطعاتی با سایزهای مختلف، وجود آلودگی DNA | کاهش غلظت DNA الگو، کاهش زمان تکثیر در برنامه دمایی PCR، افزایش دمای اتصال پرایمر در برنامه دمایی PCR، استفاده از مواد عاری از آلودگی احتمالی DNA |
| مشاهده باند غیر اختصاصی | اتصال غیر اختصاصی پرایمرها به الگو | طراحی پرایمرهای اختصاصی، تنظیم دما و زمان اتصال پرایمر به الگو، کاهش مدت زمان تکثیر در هر سیکل |
| مشاهده پرایمر دایمر | اتصال پرایمرهای رفت و برگشت به یکدیگر | طراحی پرایمرهایی با امکان تشکیل پرایمر دایمر کمتر کاهش غلظت پرایمرها در واکنش PCR عدم تهیه میکس پرایمرها |
الکتروفورز نمونه های RNA
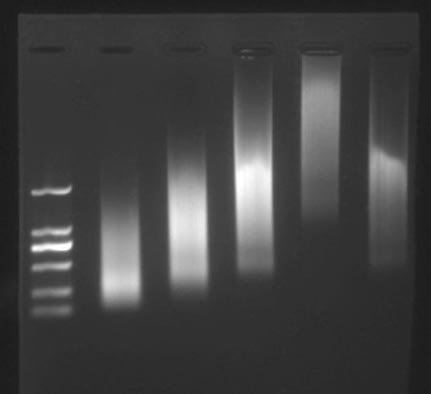
پس از انجام الکتروفورز نمونه RNA استخراج شده انتظار می رود یک الگوی سه بانده متشکل از باندهای ۲۸s، ۱۸s و ۵s مربوط به RNA های ریبوزومی بر روی ژل مشاهده گردد که در حالت ایده آل ضخامت باند ۲۸s دو برابر ۱۸s باشد و اسمیری در بالا و پایین ژل مشاهده نشود.
| مشکل | علت | راه حل |
| عدم مشاهده باند | نمونه RNA استخراج نشده است | استفاده از بافت یا سلول تازه و به میزان کافی جهت استخراج |
| مشاهده اسمیر | RNA استخراج شده تجزیه شده است | از نمونه بافت یا سلول تازه استفاده شود اصلاح روش استخراج (در طول استخراج از پیپتاژ کردن یا انجام روش های harsh خودداری شود) |
| مشاهده باند در چاهک های ژل | وجود آلودگی ژنومی | استفاده از کیت استخراج RNA، دقت در جداسازی فاز رویی و عدم انتقال فاز میانی حاوی DNA در مرحله جداسازی RNA از سایر ترکیبات در روش ترایزول |
الکتروفورز نمونه پلاسمید
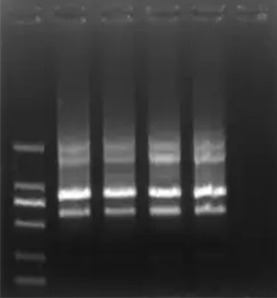
پس از انجام الکتروفورز نمونه پلاسمید استخراج شده در حالت ایده آل یک الگوی سه بانده متشکل از پلاسمید سوپرکویل، پلاسمید خطی شده و پلاسمید دارای nick بر روی ژل مشاهده می گردد. مطلوب است باند سوپرکویل نسبت به دو باند دیگر بسیار شارپ تر باشد که بیانگر کیفیت بالای پلاسمید استخراج شده خواهد بود.
| مشکل | علت | راه حل |
| عدم مشاهده باند | پلاسمید استخراج نشده یا تجزیه شده | استفاده از کشت باکتری تازه استفاده از محلول های استخراج تازه |
| مشاهده اسمیر | پلاسمید تجزیه شده است | استفاده از کیت استخراج پلاسمید در روش دستی، در مراحل حساس، شرایط harsh اعمال نشود |
| مشاهده باند سوپرکویل ضعیف و باند شارپ پلاسمید خطی | پلاسمید شکسته شده است | رعایت دقیق زمان انکوباسیون در مرحله جدا سازی پلاسمید از DNA ژنومی، عدم اعمال شرایط harsh در مراحل حساس |
| مشاهده باند در چاهک ژل | آلودگی ژنومی | استفاده از کیت استخراج پلاسمید، دقت در جداسازی محلول حاوی پلاسمید از رسوب DNA ژنومی، عبور دادن محلول پلاسمید جداسازی شده از کاغذ صافی |
| مشاهده باند اضافی زیر باند سوپرکویل | انکوباسیون بیش از حد لیزات سلولی در محلول شماره | رعایت دقیق زمان انکوباسیون در مرحله جدا سازی پلاسمید از DNA ژنومی |
| مشاهده باند در پایین ژل | آلودگی RNA | استفاده از آنزیم RNase جهت حذف RNA |
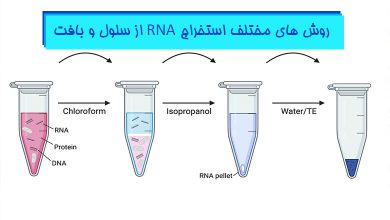
مطالب مرتبط: روش های مختلف استخراج RNA از سلول و بافت – روش های از بین بردن DNA ژنومی در RNA استخراج شده – عیب یابی استخراج RNA
خدمات مرتبط: استخراج RNA و DNA سنتز cDNA ، طراحی پرایمر ، انجام تکنیک Real time PCR