بیماری های سیستم عصبی

سیستم عصبی شامل مغز و نخاع است که با هم سیستم عصبی مرکزی (CNS) را تشکیل می دهند . مغز اطلاعات دریافتی را یکپارچه می کند و با پردازش این پیام های دریافتی می تواند فعالیت قسمت های مختلف بدن را هماهنگ کند. طبق تعریف سازمان جهانی بهداشت (WHO)، بیماری های عصبی هر بیماری است که کل سیستم عصبی (یعنی سیستم عصبی مرکزی و محیطی) از جمله مغز، نخاع، اعصاب جمجمه و اعصاب محیطی را تحت تأثیر قرار دهد.
عملکرد سیستم عصبی توسط عوامل زیادی می تواند تحت تاثیر قرار گیرد و دچار اختلال شود این عوامل می تواند شامل عوامل درونی و عوامل محیطی باشد .
عوامل داخلی که اصطلاحا (عناصر نوروتروفیک ) نامیده می شوند، با کنترل بقا، رشد و عملکرد بافت و سلول های عصبی بر سیستم عصبی تأثیر می گذارند. این عوامل با فعال کردن مسیرهای سیگنال دهی متعدد و انواع متمایز گیرنده ها و ایجاد ارتباط بین قسمت های مختلف سیستم عصبی به یکپارچگی عملکردی خود سیستم عصبی کمک میکند . از جمله این عوامل درونی می توان به فاکتور رشد عصبی (NGF) ، فاکتور نوروتروفیک مشتق از مغز (BDNF) اشاره کرد .
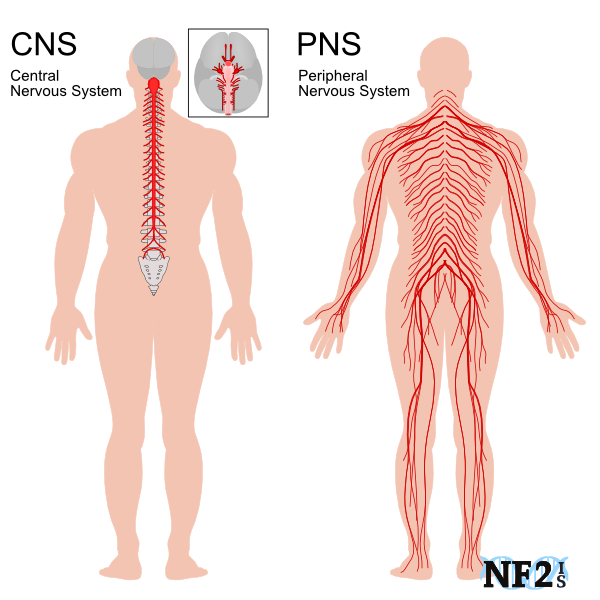
تصویر ۱: اجزای مختلف سیستم عصبی
علاوه بر این سیستم عصبی می تواند تحت تاثیر عوامل بیرونی هم قرار گیرد . به طور مثال سبک زندگی، استرس فیزیکی و روانی ، آلودگی های محیطی مانند آلودگی های صوتی و آب و هوا می تواند بر عملکرد سیستم عصبی تاثیر بگذارد و باعث ایجاد بیماری های روانی و عصبی می شود که در همه سنین در بیماران ظاهر می شود. هر چند گزارش شده است بیماری های عصبی اغلب با افزایش سن و پیری بروز پیدا می کنند با این حال در سالهای اخیر گسترش و ظهور بیماری های عصبی در جوانان و حتی نوجوانان به معضل فراگیر تبدیل شده است . از جمله شایعترین بیماریهای عصبی خطرناک در جوانان می توان به مننژیت و صرع اشاره کرد .
بیماری های عصبی را می توان بر حسب اثر گذاری بر سیستم عصبی مرکزی و محیطی به دو دسته بیماری های سیستم عصبی مرکزی و بیماری های سیستم عصبی محیطی تقسیم کرد .
بیماری های سیستم عصبی مرکزی و محیطی :
آلزایمر (AD): آلزایمر یک بیماری عصبی است که با آسیب به مناطقی از مغز که مسئول تفکر، یادگیری و حافظه و همچنین شناخت هستند، مشخص میشود. این بیماری تا حد زیادی به دلیل تجمع پروتئین های خاص – پلاک های بتا آمیلوئید(Aβ) و و پروتئین تاو در مغز است. این بیماری بیش از یک قرن پیش توسط فردی به نام آلویس آلزایمر در آلمان شناسایی شد . بیماری آلزایمر، شایع ترین علت زوال عقل می باشد و تقریباً دو سوم موارد مبتللایان به زوال عقل را تشکیل می دهد و بیش از ۳۵ میلیون نفر در سراسر جهان ، از جمله بیش از ۵.۴ میلیون آمریکایی، را مبتلا کرده است . این بیماری یک اختلال پیشرونده فراگیر است که معمولاً در ابتدا با از دست دادن شدید حافظه، به ویژه حافظه اپیزودیک، ظاهر می شود. فرضیه آبشار آمیلوئید برای اولین بار در سال ۱۹۹۱ توسط هاردی و آلسوپ ارائه شد. آنها یک جهش بیماریزا را در ژن پروتئین پیش ساز Aβدر کروموزوم ۲۱ در بیماران مبتلا به AD شناسایی کردند. این جهش باعث رسوب Aβ می شود که اولین سیگنال در پیشرفت بیماری AD به شمار می رود . در حال حاضر، این اختلال به طور کامل قابل درمان نیست، بنابراین گسترش تحقیقات علمی و توسعه داروهای پیشبالینی برای این بیماری ضروری به نظر می رسد . در این بین مدلهای حیوانی نقش عمدهای در تعریف مکانیسمهای مهم مرتبط با بیماری ایفا کردهاند و در خط مقدم ارزیابی برنامه ها و رویکردهای درمانی جدید بودهاند. تا به امروز، اکثریت قریب به اتفاق مدلهای حیوانی ، منحصراً متشکل از موشهای تراریخته می باشند که ژنهای مسئول تشکیل پلاکهای آمیلوئید را بیان میکنند. با این حال محدودیت هایی از جمله اینکه مکانیسم ایجاد آلزایمر در این مدل ها عمدتا غیرفیزیولوژیکی است استفاده از آنها را دچار چالشهایی کرده است . بعد از کشف این نکته که Aβ ماده اصلی تشکیل دهنده پلاک های آمیلوئید در مغز بیماران مبتلا به AD استو برای نورون ها سمی است منجر به علاقه به گسترش مطالعات in vivo در مورد اثرات Aβ در مغز شد. اثر تخریب کننده عصبی Aβ در مغز بیماران مبتلا به AD در داخل بدن برای اولین بار در سال ۱۹۹۱ نشان داده شد، زمانی که این مواد به مغز دو مدل مختلف موش تزریق شد در هر دو مورد، القای قابل توجهی از فسفوریلاسیون غیر طبیعی تاو در مجاورت مکانهای واکنشپذیر Aβ مشاهده شد. هر چند در سال های بعد، چندین مطالعه نتایج متناقضی از تزریق حاد یا تزریق مداوم Aβ به طور مستقیم به مغز موش گزارش کردند. با این حال طیف زیادی از مطالعات سمیت عصبی، آستروگلیوز شبیه AD، هیپرفسفوریلاسیون تاو و/یا کاهش حافظه را در مدلهای تجربی القا شده با تزریق درون مغزی Aβ در موشها نشان دادند.
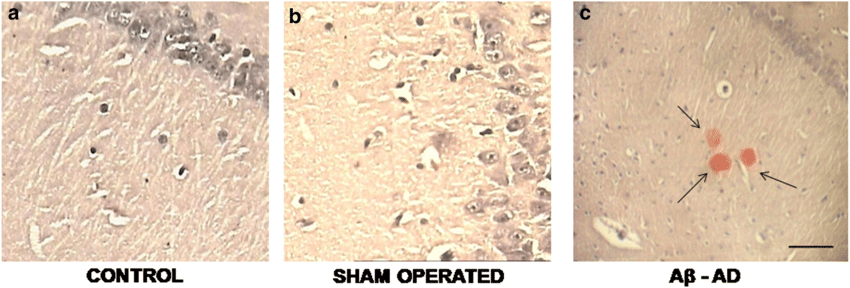
تصویر ۵ : تشکیل پلاک های آمیلوئید(پلاک های قرمز رنگ ) بتا در مدل حیوانی الزایمر
- سکته مغزی: سکته مغزی یکی از بیماری های عصبی خطرناک است و زمانی اتفاق می افتد که بخشی از مغز جریان خون کافی نداشته باشد. به طور عمده دو نوع سکته مغزی وجود دارد: ایسکمیک و سکته ناشی از خونریزی . سکته مغزی ایسکمیک عمدتاً به دلیل انسداد شریانی در مغز اتفاق میافتد در حالی که سکته هموراژیک یا ناشی از خونریزی ، با پاره شدن عروق خونی و در نتیجه خونریزی در سطح مغز رخ می دهد . بدون وجود جریان مداوم خون، سلول های مغز در آن ناحیه به دلیل کمبود اکسیژن شروع به مردن می کنند.
طیف زیادی از عوامل میتواند سبب بروز سکته شود که می توان آن ها را به موارد تغییرپذیر مانند کم تحرکی، چاقی، فشار خون بالا، دیابت، سیگار کشیدن، مصرف بیش از حد الکل یا غیرقابل اصلاح مانند سن، جنس و ژنتیک دسته بندی کرد
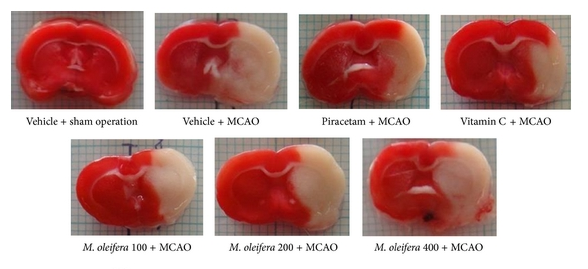
تصویر ۲ : مرگ سلول های مغز(ناحیه سفید رنگ ) بر اثر سکته مغزی در مدل حیوانی سکته مغزی
- پارکیسنون : بیماری پارکینسون یک اختلال حرکتی است که می تواند بر سیستم عصبی تاثیر می گذارد. پارکینسون که عمدتا با اصطلاح “فلج تکان دهنده” شناخته می شود در نتیجه مرگ و از دست دادن نورون های دوپامینرژیک در جسم سیاه تالاموس رخ می دهند .
برخی از علائم این بیماری عبارتند از :
- لرزش غیر ارادی قسمت های خاصی از بدن
- حرکت آرام
- ماهیچه های سفت و غیر قابل انعطاف
- مشکلات خواب یا بی خوابی
- اختلال حافظه
از آنجایی که اکثر موارد PD علت ایجاد بیماری نامشخص است، تنها درمان های علامتی مانند دارودرمانی، جراحی مغز و اعصاب استریوتاکسیک و فیزیوتراپی برای این بیماری در حال استفاده می باشد . اگرچه این درمانها علائم حرکتی را کاهش میدهند و کیفیت زندگی بیمار را تا حدی بهبود میبخشند با این حال گسترش روز افزون این بیماری مطالعات برای کشف درمانهای جدید و موثر تر برای پیشگیری، توقف یا کند کردن پیشرفت بیماری ضروری میباشد . برای توسعه چنین استراتژیهایی ، استفاده از مدل های حیوانی یکی از راه های مناسب جهت بررسی اثر بخشی برنامه های درمانی میباشد .
یکی از مدل های ایجاد شده برای پارکینسون استفاده از ۶ هیدروکسی دوپامین( ۶-(OHDA می باشد . ۶- OHDA آنالوگ دوپامین و نوراپی نفرین است. این ترکیب به صورت درون زا از طریق هیدروکسیلاسیون متابولیت های دوپامین تولید می شود و در هسته دمی انسان یافت شده است. ۶-OHDA ازسد خونی مغزی ( BBB) عبور نمی کند و نیاز به تزریق مستقیم به مغز برای القای تخریب عصبی دارد.پس از تزریق از طریق انتقال دهنده های مونوآمین وارد نورون های دوپامینرژیک و نورآدرنرژیک می شود. ۶-OHDA با مهار کمپلکس میتوکندری I و با تولید گونههای فعال اکسیژن (ROS)، مانند رادیکالهای سوپراکسید، رادیکالهای هیدروکسیل و پراکسید هیدروژن، مرگ سلولی را از طریق استرس اکسیداتیو القا میکند. در موشها، تزریق ۶-OHDA منجر به دژنراسیون ۹۰ درصدی دوپامینرژیک در عرض ۲۴ ساعت و از دست دادن دوپامین جسم مخطط در عرض چند روز میشود
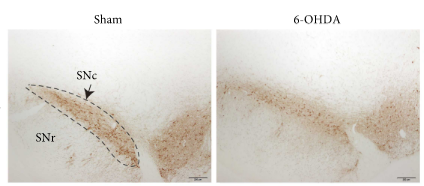
تحلیل رفتن جسم سیاه در مدل حیوانی پارکینسون القا شده با ۶ هیدروکسی دوپامین (رنگ آمیزی ایمونو هیستوشیمی )
- میگرن: یک بیماری عصبی- عروقی مزمن است که با حملات مکرر درد ضربان دار متوسط تا شدید در یک طرف سر مشخص می شود. این سردرد معمولا با حالت تهوع نیز همراه است. این درد ناشی از فعال شدن رشتههای عصبی در دیواره رگهای خونی مغز است که در داخل مننژها (سه لایه غشایی که از مغز و نخاع محافظت میکنند).قرار دارند.
- بیماری MS : مولتیپل اسکلروزیس یا (MS) یک بیماری خود ایمنی است که می تواند مغز، نخاع و اعصاب بینایی را ، که سیستم عصبی مرکزی را تشکیل میدهند ، تحت تاثیر قرار دهد . علت دقیق ام اس ناشناخته است، اما تحریک سیستم ایمنی و حمله آن به سیستم عصبی مرکزی و متقابلا آسیب به میلین ، مهمترین مکانیسم ایجاد این بیماری می باشد .. آسیب حاصله به میلین، که به عنوان لایه محافظ رشته های عصبی شناخته می شود ، سیگنال های ورودی و خروجی مغز را مختل می کند. این قطع سیگنال های ارتباطی باعث علائم غیرقابل پیش بینی مانند بی حسی، گزگز، تغییرات خلقی، مشکلات حافظه، درد، خستگی، کوری و/یا فلج می شود. تجربه همه افراد با ام اس متفاوت است و این آسیب ها ممکن است موقت یا طولانی مدت باشند. در کنار ماهیت و مکانیسم پیچیده MS و از آنجایی که روابط متقابل پیچیده ای بین سلول ها، بافت ها و اندام ها در انسان ها وجود دارد و تغییرات ظریف در سطح مولکولی می تواند تأثیر عمیقی بر کل ارگانیسم داشته باشد ایجاد مدل های حیوانی برای این بیماری را دشوار کرده است . با این حال تا کنون چندین مدل برای انجام مطالعات در زمینه MS به کار ایجاد شده است .
آنسفالومیلیت خودایمنی تجربی (EAE) متداول ترین مدل حیوانی مورد استفاده در تحقیقات ام اس است و به طور مستقیم در توسعه تعدادی از درمان های خط اول که فاز التهابی بیماری را هدف قرار می دهند، کمک کرده است. استفاده از کوپریزون روش دیگر القای مدل MS می باشد کوپریزون باعث مرگ الیگودندروسیت خاص و متعاقب آن دمیلیناسیون می شود. کوپریزون یک شلاتور یون مس (Cu2+) است و با اختلال در متابولیسم سلولی باعث آپوپتوز الیگودندروسیتی در عرض چند روز می شود که با فعال شدن سلول های ایمنی ذاتی در مغز یعنی آستروسیت ها و میکروگلیاها مشخص می شود و در نهایت منجر به دمیلین شدن نواحی متمایز ماده سفید و خاکستری مغز می شود
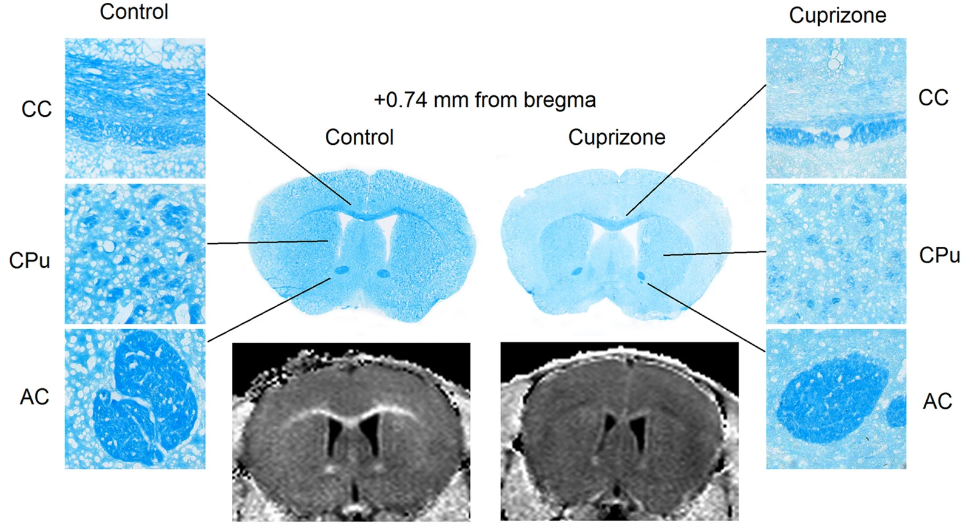
تصویر ۶ : افزایش دمیلیناسیون مغز در مدل القا شده با کوپریزون (رنگ آمیزی لوکسال فست بلو )
- تشنج یا صرع : تشنج یک انفجار ناگهانی و کنترل نشده از فعالیت الکتریکی در مغز است . این وضعیت میتواند باعث تغییر در رفتار، حرکات، احساسات و سطوح هوشیاری شود. داشتن دو یا چند تشنج به فاصله حداقل ۲۴ ساعت که علت مشخصی نداشته باشد، صرع محسوب می شود. حملات تشنجی مکرر می توانند باعث آسیب عصبی و نکروز سلولی و تشدید اختلال عملکرد مغزی شود . حدود ۶۵ میلیون نفر در سراسر جهان صرع را تجربه میکنند. بنابر این مطالعه داروهای ضد صرع و توسعه استراتژی های درمانی یک نیاز اساسی به شمار می رود . در سالهای اخیر مدلهای حیوانی صرع برای بررسی داروهای ضدصرع (AEDs) و توسعه درمانهای جدید گسترش پیدا کرده است و به طور قابل توجهی روند مطالعات مرتبط با صرع را سرعت بخشید. در بین حیوانات، سگ ها و گربه ها در چند سال گذشته در اولویت قرار گرفته اند اما اخیراً جوندگان و موشها به طور فزایندهای به عنوان گونهای محبوب برای مدلهای حیوانی مبتلا به صرع در نظر گرفته میشوند، بهویژه آنهایی که شامل جهشهای ژنی و فناوری اصلاحشده ژنتیکی هستند. تحریک مکرر الکتریکی یا کیندلینگ روش عمده القای مدل های حیوانی صرع هستند. کیندلینگ کلاسیک تحریک الکتریکی مکرر ساختارهای لیمبیک است که منجر به ترشحات غیرطبیعی و حملات تشنجی می شود. کیندلینگ عمدتا به دو نوع الکتریکی و شیمیایی تقسیم می شود. کیندلینگ الکتریکی به الکترود عمیق کاشته شده در ناحیه لیمبیک مغز، به عنوان مثال، آمیگدال و هیپوکامپ اشاره دارد. برعکس، کیندلینگ شیمیایی به تزریق سیستماتیک ماده تحریک کننده به مغز اشاره دارد که منجر به حملات تشنجی می شود. به طور مثال پنتیلن تترازول (PTZ) به عنوان یک عامل شیمیایی بالقوه صرع زا عمل می کند. تزریق ورید دمی یا تزریق داخل صفاقی PTZ می تواند باعث ایجاد تشنج تونیک-کلونیک در موش صحرایی شود .
- اوتیسم : اختلال طیف اوتیسم (ASD) به گروهی از ناتوانی های رشدی اطلاق می گردد که با اختلال در تعامل اجتماعی و ارتباطات و علایق/رفتارهای محدود و تکراری مشخص می شود. با پیشرفت در ژنومیک انسانی تعداد زیادی از تغییرات ژنتیکی مرتبط با ASD را شناسایی کرده است. این تغییرات به سرعت توسط تعداد فزاینده ای از مطالعات با استفاده از رویکردهای مختلف، از جمله بررسی های ژنتیکی در مدل های حیوانی ، مورد بررسی قرار گرفته اند ، این مطالعات همچنین مکانیسمهای کلیدی پاتوژنز ASD را شناسایی کردهاند که بسیاری از آنها شامل اختلالات سیناپسی هستند، و استراتژیهای درمانی جدید و مبتنی بر مکانیسم را بررسی کردهاند. نتایج بسیاری از مطالعات در زمینه بررسی مکانیسم های زمینه ساز اوتیسم. از جمله مطالعات نوروآناتومیک ، ماکروسفالی و اتصال عصبی غیرطبیعی را در افراد اوتیستیک گزارش کردهاند، در حالی که مطالعات ژنتیکی با استفاده از مدلهای موش، انواع پروتئینهای عصبی را در ایجاد ASD نقش را بررسی کرده اند . اخیراً، نقص در تعدادی از پروتئینهای سیناپسی پیشنهاد شده است که باعث ایجاد ASD از طریق تغییرات در ساختار/عملکرد سیناپسی و مدارهای عصبی میشود، که نشان میدهد «سیناپتوپاتی» یا اختلال عملکرد سیناپسی یک جزء مهم ASD است. تغییری که اغلب در مغز افراد مبتلا به ASD مشاهده می شود، رشد بیش از حد مغز است که ماکروسفالی نامیده می شود، که در حدود ۲۰٪ از کودکان اوتیستیک مشاهده می شود. انحرافات در طول رشد اولیه مغز در مناطقی از جمله لوب فرونتال، لوب جداری-گیجگاهی، مخچه و ساختارهای لیمبیک زیر قشری در بیماران اوتیسم مشاهده می شود
- اسکلروز جانبی آمیوتروفیک ((Amyotrophic lateral sclerosis ) : معروف به ALS، یک بیماری سیستم عصبی است که سلول های عصبی در مغز و نخاع را تحت تاثیر قرار می دهد. ALS باعث از دست دادن کنترل عضلات می شود. این بیماری با گذشت زمان بدتر می شود. علت دقیق این بیماری هنوز مشخص نیست. ALS اغلب با انقباض عضلانی و ضعف در بازو یا پا، مشکل در بلع یا تکلم شروع می شود. در نهایت ALS بر کنترل ماهیچه های مورد نیاز برای حرکت، صحبت کردن، خوردن و تنفس تأثیر می گذارد
- مننزیت : مننژیت به التهاب لایه های محافظ اطراف مغز و نخاع (مننژ) گفته می شود که میتواند ناشی از وجود باکتری ها، ویروس ها، قارچ ها، انگل ها و شرایط غیر عفونی باشد . علائم مننژیت عمدتا شامل تب، سردرد شدید، سفتی گردن، حالت تهوع، استفراغ و حساسیت به نور است.
- ادم مغزی : ادم مغزی به تورم بخشی یا تمام مغز، که به دلیل وجود مایع اضافی در سلولها یا بافتهای خارج سلولی مغز ایجاد میشود، گفته می شود. از جمله دلایل ایجاد ادم مغزی می توان به آسیب فیزیکی مغزی، سکته مغزی، عفونت های باکتریایی یا ویروسی (مانند مننژیت و آنسفالیت)، تومورها، آبسه ها، فشار خون بالا، هپاتیت، هیپوناترمی (سطح پایین سدیم در خون)، اشاره کرد .
- تومور خوش خیم : تومور مجموعه ای غیر طبیعی از سلول ها است و زمانی شکل میگیرد که سلولها بیش از حد تکثیر می شوند . تومور می تواند بدخیم (سرطانی) یا خوش خیم (غیر سرطانی) باشد. تومور های خوش خیم عموما خطرناک نیستنند اما اگر این تومور ها بر ساختارهای حیاتی مانند عروق خونی یا اعصاب فشار بیاورند می توانند جدی باشند. جراحی یک نوع رایج درمان برای تومورهای خوش خیم است و هدف آن حذف تومور بدون آسیب رساندن به بافت های اطراف است. انواع دیگر درمان ممکن است شامل دارو یا پرتودرمانی باشد. الیگودندروگلیوما (Oligodendrogliomas)، مننژیوم (Meningioma)، کرانیوفارنژیوم (Craniopharyngioma)، همانژیوبلاستوم (Hemangioblastoma) ، آدنوم هیپوفیز(Adenoma ) از جمله مهمترین نوع تومور های خوش خیم به شمار می روند .
- آسیب عصب سیاتیک : عصب سیاتیک در پشت ساق پا قرار دارد. ماهیچه های پشت زانو و ساق پا را تامین می کند. عصب سیاتیک همچنین در پشت ران، قسمتی از ساق پا و کف پا احساس می کند. رشته های عصبی محیطی دو عملکرد اصلی انتقال پیام های حسی و عصبی- حرکتی را بر عهده دارند : بنابر این پس از بروز آسیبهای عصبی، علائم مختلفی مانند آتروفی عضلانی و درد نوروپاتیک ایجادمی شود که می تواند بر فعالیتهای روزمره زندگی و وضعیت روانی تأثیر میگذارد.آسیب عصب سیاتیک عمدتا به دلیل ضربه (فشار، کشش یا برش) به عصب رخ می دهد و می تواند علائمی مانند از دست دادن قدرت عضلانی و درد را به دنبال داشته باشد .عصب آسیبدیده تحت تغییرات شیمیایی و ساختاری زیادی قرار میگیرند، که برخی از آنها مستقیماً با فرایند رشد و بازسازی عصب مرتبط هستند. این تغییرات ممکن است در درازمدت ناسازگار باشند و میتوانند منجر به درد نوروپاتیک شوند
- آسیب نخاعی : نخاع سیگنال هایی را بین مغز و بقیه بدن ارسال و دریافت می کند. آسیب نخاعی شامل آسیب به هر بخشی از نخاع می شود که اغلب باعث تغییرات دائمی در قدرت، احساس و سایر عملکردهای بدن در قسمت های پایین تر از محل آسیب می شود. اصطلاح “ضایعه نخاعی” به آسیب نخاعی ناشی از ضربه (مثلاً تصادف اتومبیل) یا بیماری (مانند سرطان) اشاره دارد. میزان بروز سالانه جهانی ۴۰ تا ۸۰ مورد در هر میلیون جمعیت برآورد شده است. تا ۹۰ درصد از این موارد ناشی از علل تروماتیک است، اگرچه به نظر می رسد نسبت آسیب نخاعی غیرتروماتیک هم در حال افزایش است. علائم آسیب نخاعی به شدت آسیب و محل آن بر روی نخاع بستگی دارد. علائم ممکن است شامل از دست دادن جزئی یا کامل عملکرد حسی یا کنترل حرکتی بازوها و پاها باشد. شدیدترین نوع آسیب نخاعی بر سیستم هایی تأثیر می گذارد که کنترل روده یا مثانه، تنفس، ضربان قلب و فشار خون را تنظیم می کنند
- میاستنی گراویس : میاستنی گراویس یک بیماری عصبی عضلانی مزمن است که باعث ضعف در عضلات ارادی می شود. ماهیچه های ارادی شامل عضلاتی هستند که به استخوان ها، عضلات صورت، گلو و دیافراگم فرد متصل می شوند. این عضلات برای حرکت بازوها و پاها منقبض می شوند و برای تنفس، بلع و حرکات صورت ضروری هستند. میاستنی گراویس یک بیماری خودایمنی است، به این معنی که سیستم دفاعی بدن به اشتباه به سلول های سالم یا پروتئین های مورد نیاز برای عملکرد طبیعی این عضلات حمله می کند و آنها را از بین می برد .
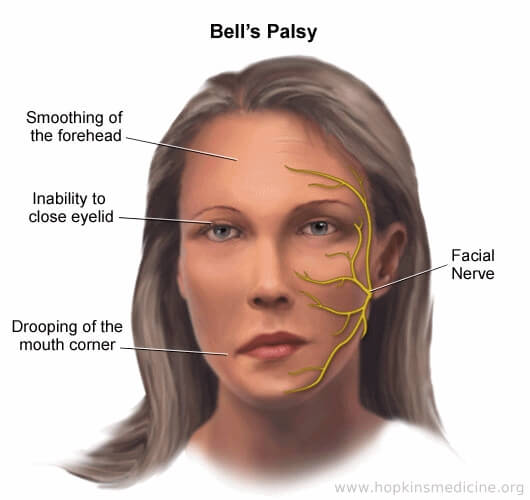
فلج بل:
فلج بل وضعیتی است که باعث ضعف ناگهانی ماهیچه های یک طرف صورت می شود. در بیشتر موارد، ضعف موقتی است و طی هفته ها به طور قابل توجهی بهبود می یابد. ضعف باعث می شود نیمی از صورت افتاده به نظر برسد. لبخندها یک طرفه هستند و چشم در سمت آسیب دیده در برابر بسته شدن مقاومت می کند.
عوامل خطر آن عبارتند از: عفونت گوش میانی، قرار گرفتن در معرض سرمای شدید عفونت دستگاه تنفسی فوقانی، احتباس آب در بارداری، عفونت ویروسی و غیره. ویژگی های بالینی عبارتند از انحراف صورت به سمت سالم، فلج عضلات حالت چهره در طرفین.
تصویر ۴ : فلج بل
در سالهای اخیر بیماری های سیستم عصبی به شدت گسترش پیدا کرده است و این و ضعیت با مدرن شدن جوامع در حال شدت گرفتن نیز می باشد به طوری که طبق گزارش WHO، تا سال ۲۰۳۰، بیماری های سیستم عصبی بر سایر بیماریهای مانند سرطانی و اختلالات متابولیک غلبه خواهد کرد بنیابر این توجه به این گونه بیماری ها و بررسی استراتژی های درمانی ضروری به نظر می رسد . در این بین استفاده از مدل های حیوانی و مختلف می تواند به ما در جهت بررسی این استراتژی ها کمک شایانی کند. برای بررسی اثرات دارو های درمانی طیف وسیعی از تست های بیوشیمیایی ، ژنتیکی و تست های رفتاری طراحی شده اندتا میزان اثر گذاری دارو ها مونرد ارزیابی قرار گیرند .
منابع:
doi: 10.3390/nu15061436
https://www.physio-pedia.com/Neurological_Disorders
تصویر ۱ : https://www.nf2is.org/tumor_damage.php
تصویر۲ : https://doi.org/10.1155/2013/951415
تصویر ۳ : https://www.socalhip.com/sciatica-hip-pain-causes-and-treatment/
تصویر ۴ : https://www.entspecialistinbangalore.com/bells-palsy/
doi: 10.1111/j.1582-4934.2009.00781.x
تصویر ۵ : DOI:۱۰.۱۰۰۷/s12031-018-1189-9
doi: 10.14336/AD.2021.0723