انواع مدل های نقص جنینی
انواع روش های ایجاد مدل های نقص جنینی در حیوان آزمایشگاهی
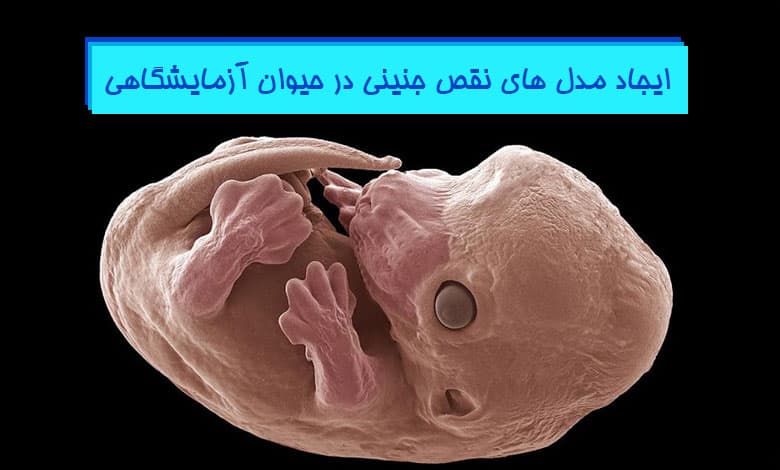
ایجاد انواع مدل های نقص جنینی
رشد طبیعی جنینی اندام ها و سایر بافت ها در همه گونه ها توسط ژن ها از پیش برنامه ریزی شده است. غیرفعال شدن یک ژن دخیل در هر مرحله از رشد طبیعی جنین می تواند عواقب شدیدی داشته باشد که منجر به نقایص رشد جنینی یا مرگ پس از تولد شود. روشهای پاتولوژی برای ارزیابی جفت و جنین طبیعی و غیرطبیعی، بعد از روز دوازدهم بارداری (E12) بررسی میشوند. که شامل مراحل پاتولوژی و هیستوپاتولوژی برای ارزیابی جنین از جمله اطلسهای بافتشناسی و تکنیکهای تصویربرداری پیشرفته جنینی می شود.
در سالهای اخیر، مدلهای نقص جنینی متنوعی در پستانداران توصیف شدهاند که پتانسیل بسیار زیادی برای بررسی سؤالات اساسی در زیستشناسی رشد و تکوین دارند، به ویژه در مورد جنین انسان که محدودیتهای اخلاقی و فنی، تحقیقات را محدود میکند.
مراحل بارداری در موش آزمایشگاهی
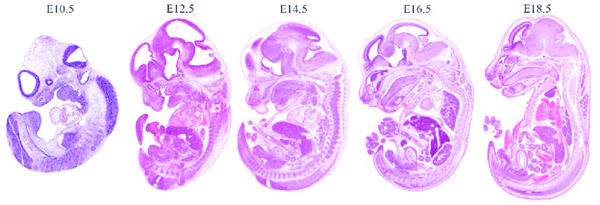
رشد جنین پس از لقاح تخمک اتفاق می افتد. رشد در روزهای جنینی (E) به صورت گذراندن ۴ دوره اصلی شناسایی می شود:
- قبل و بعد از لانه گزینی (E0-4.5)
- تمایز لایه های زاینده (E6-9)
- توسعه سیستم قلبی عروقی و جفت (E9 -12)
- تمایز بافت و اندام (E12-19)
زمانی که یک vaginal plug مشاهده می شود به طور کلی به عنوان E0.5 بارداری تعریف می شود.
مطلب پیشنهادی: رنگ آمیزی های اختصاصی بافت شناسی – مراحل پرفیوژن و فیکس کردن بافت در بدن حیوانات آزمایشگاهی
تاثیر بیان ژن ها در نقص جنینی
ژن ها مختلف در طول بارداری و رشد طبیعی و تمایز اندام ها بیان می شوند. ژنهایی که معمولاً در سطوح بالایی در طول رشد داخل رحمی بیان میشوند ممکن است تأثیرات عمیقی بر اندام زایی و تمایز داشته باشند. به عنوان مثال؛ ژن NKX2-1 دستورالعمل هایی را برای ساخت پروتئینی به نام پروتئین هومئوباکس Nkx-2.1 ارائه می دهد که تشکیل ساختارهای بدن را در طول رشد اولیه جنین هدایت می کنند وغیرفعال شدن آن باعث عدم رشد طبیعی ریه (فقدان انشعاب ریه که منجر به مرگ می شود)، عدم وجود غده هیپوفیز و تیروئید و همچنین هیپوتالاموس غیرطبیعی می شود.
تخمین زده می شود که ۵ الی ۱۵% جنین های بارور شده ممکن است دارای نقص جنینی کشنده باشند
برای تعیین علت مرگ جنین یا تعیین نقایص رشد که در جنین های زنده یا مرده یا موش های نوزاد، پری ناتال یا پس از تولد یافت می شود، ابتدا باید سلول ها و بافت هایی که ژن مورد نظر را بیان می کنند، تعیین کرد.
تاثیر ناهنجاری های رحم، جفت در نقص جنینی
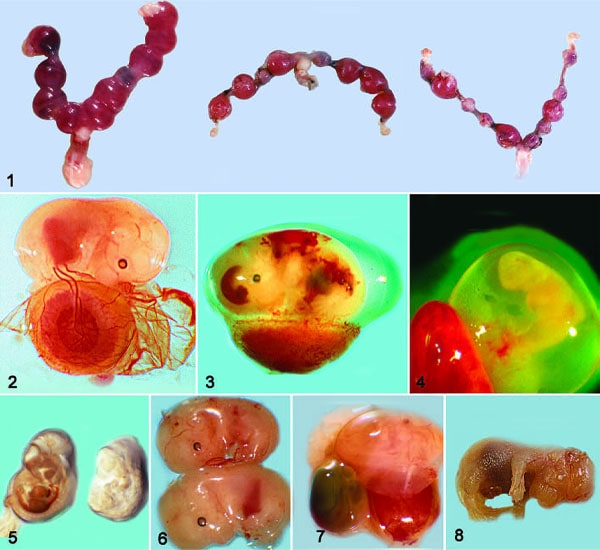
در تصویر ۱، جنین E12 جنین طبیعی را نشان می دهد، که رگ های ناف آن به لابیرنت جفت متصل هستند (ناحیه دیسکوئید قرمز). تغییرات اولیه جنینی ممکن است شامل از دست دادن ضربان قلب طبیعی یا ظاهر غیرطبیعی یا از دست دادن رگ های خونی یا گلبول های قرمز در رگ های خونی قابل مشاهده باشد.
با مرگ جنین، جفت نیز دچار ضایعات دژنراتیو و در نهایت نکروزه می شود. تعداد مکانهای غیر طبیعی جفت (لانهگزینی) که در طول بارداری ایجاد میشوند به ماهیت نقص در طول رشد طبیعی جفت یا جنین بستگی دارد. اگر ناهنجاری های عروقی در جفت ایجاد شود، ممکن است ضایعات هموراژیک دیده شود.
در تصویر ۲، شواهد اولیه مرگ و میر جنینی کاهش اندازه و تغییر رنگ محل طبیعی جفت در رحم را نشان می دهد. رحم موش در E12، E10، و E10 مکان های لانه گزینی غیر طبیعی (جفت) است.
تصویر ۳، E13 جنین با اندازه طبیعی را با خونریزی های شدید به دلیل نقص پلاکتی نشان می دهد. خونریزی های کانونی ممکن است ظاهر شوند و مناطق وسیعی از خونریزی اغلب نشان دهنده نقص مگاکاریوسیت یا پلاکت است.
معمولا بعد از E13، همانطور که تغییرات شدیدتری ایجاد می شود، ساختار طبیعی جنین از بین می رود زیرا ماهیت آمورف تر می شود (تصویر ۴-۶). به اندازه کوچکتر جنین و از دست دادن رنگ طبیعی و ساختار بافت توجه کنید.
در تصویر ۶، مرحله E14 جنین کوچکتری را نشان می دهد که دارای نکروز کانونی بافت های مختلف از نظر بافت شناسی است.
مطلب پیشنهادی: تعیین سیکل باروری موش و رت آزمایشگاهی
در تصویر ۷، جنین زنده، کیسه زرده و جفت در سمت راست و جنین نکروز مرحله پایانی مجاور در سمت چپ مشاهده می شود.
تصویر ۸، اگزانسفالی در یک موش تازه متولد شده را نشان می دهد.
در نهایت، جنین می میرد و با گذشت زمان، اندازه جنین به تدریج کاهش می یابد و به ساختاری بی رنگ و بی شکل تبدیل می شود که به عنوان جنین قابل تشخیص نیست.
ارزیابی رشد جفت در نقص جنینی
عدم رشد طبیعی جفت منجر به مرگ جنینی اغلب در E10 و معمولاً قبل از E13 می شود. رشد جفت، معمولا تا E12.5 کامل شده است، ممکن است به دلیل انواع نقایص رشدی غشاء (به عنوان مثال، شکست آلانتوا در جوش خوردن به کوریون، شکست کیسه زرده، نقص مزودرم/اندودرم، فقدان اریتروپوئزیس طبیعی در کیسه زرده، نقص جفت در واسکولوژنز، تشکیل تروفوبلاست، و تشکیل دسیدو) با شکست مواجه شود.
اگر جفت به طور طبیعی رشد نکند، در تغذیه و دریافت اکسیژن جنین در حال رشد اختلال ایجاد می شود. از نظر بافت شناسی در جنین، می توان نکروز کانونی، چند کانونی یا منتشره سلول ها و بافت های مختلف را مشاهده کرد. پس از مرگ جنینی، بافت باقیمانده جذب می شود اما ممکن است ضایعات باقی مانده در محل جفت باقی بماند (شکل ۱). ساختار لابیرنت و سایر نواحی تشریحی ممکن است به خطر بیفتد و باعث اختلال در آناتومی طبیعی جفت و در نتیجه خونریزی در لابیرنت شود.
فنوتیپ های نقص جنینی از E12 تا تولد
غیرفعال شدن ژن که باعث تغییرات اولیه رشدی در E9-E10 میشود، ممکن است باعث تغییرات اولیه بافتشناسی در جفت و جنین در آن زمان شود. این تغییرات پیشرونده می تواند در نهایت منجر به مرگ جنین در طی چند روز یا بیشتر شود.
مطالب پیشنهادی: آماده سازی بافت در آزمایشگاه بافت شناسی – آماده سازی لام از بافت ها
بنابراین، در E12، جنین های مرده یا در حال مرگ ناشی از تغییرات رشد اولیه را می توان به عنوان مکان های جفت کوچکتر در رحم مشاهده کرد.
جنین هایی با تغییرات اولیه بعد از E12 ممکن است در کل دوره بارداری یا بعد از E12 زنده بمانند اما قبل از تولد می میرند. علل متداول مرگ جنینی پس از E12 شامل نقایص قلبی شامل نارسایی سیستم قلبی و عروقی و پارگی و نقایص شامل تمایز اریتروئید و مگاکاریوسیت است. اکثر جنین های در حال مرگ یا مرده یافت شده پس از E12 دارای نقص هایی هستند که قبل از E12 شروع شده است. با این حال، نقایص رشدی که در هر مرحله از بارداری برای مغز، کلیه، کبد و ریه شروع می شود ممکن است به جنین اجازه زنده ماندن در رحم را بدهد اما می تواند منجر به مرگ و میر نوزادان پس از زایمان شود.
فنوتیپ های نقص جنینی در دوره پری ناتال و پس از آن
موش ها ممکن است با نقص رشد یک اندام یا سیستم، به ویژه نقص های پوست، اسکلت، ریه ها، کلیه ها، کبد و سیستم های عصبی مرکزی، ایمنی، غدد درون ریز و تولید مثل، در دوره بارداری زنده بمانند. نقایص مربوط به جفت، اریتروئید یا رشد پلاکت و قلب اغلب منجر به مرگ و میر داخل رحمی می شود. نقایصی که در رحم ایجاد میشود ممکن است در سنین پس از زایمان کشنده باشند، مانند کلیههای کیستیک یا موشها ممکن است با ضایعات غیر کشنده مانند از دست دادن ۱ کلیه یا نارسایی تولید مثلی زنده بمانند.
این نقایص رشدی مرگ میتواند به سرعت در زمان تولد اتفاق بیفتد، مانند زمانی که فقدان ریه یا مغز طبیعی به طور چشمگیری توانایی طبیعی موجود را برای بقا، پس از زایمان را مختل میکند.
هنگامی که مرگ و میر پس از تولد رخ می دهد، محققان می توانند به جنین و نوزاد برگردند تا هیستوپاتوژنز ضایعات کشنده پس از تولد را مطالعه کنند و نقص رشدی را که منجر به مرگ شده است را تعیین کنند. با این حال موجود دارای نقایص رشد ممکن است با یا بدون عواقب بالینی زنده بماند. در انسان، این موارد شامل شکاف لب و کام، نقص لوله عصبی، بیماری کلیه پلی کیستیک، لامینوپاتی، ناشنوایی و دیستروفی عضلانی است. برخی از مدل های موش برای این بیماری های انسانی وجود دارد.
گزارش های متعددی از موش های جهش یافته وجود دارد که در بدو تولد برای مدت کوتاهی نفس می کشند و متعاقبا می میرند. برای برخی از این جهش یافته ها، علت مرگ نارسایی تنفسی ناشناخته است. وضعیت بافت شناسی ریه معمولاً طبیعی است یا فقط کمی از حالت طبیعی خارج است. در این موارد مرگ ممکن است به مکانیسم تنفس مربوط باشد نه نقص در خصوصیات بافتی یا فیزیولوژیکی ریه.
تحقیق در مورد مکانیسم تنفس تخصصی شامل دانش ویژگی های فیزیولوژیکی تنفسی و الگوهای بیان ژن در سیستم عصبی است. یک مثال عالی از نارسایی تنفسی نوزادان در موشهای دستکاری شده ژنتیکی با ژن ناک اوت Ndn گزارش شد.
فقدان ژنی که به طور معمول در طول رشد عصبی بیان می شود منجر به اختلال در کمپلکس پیش بوتزینگر می شود که برای تولید ریتم تنفسی ضروری است. در این مورد، محققان قبل از ایجاد موش های جهش یافته خود، محل آناتومیک مغز بیان ژن Ndn را می دانستند که به طور قابل توجهی به توانایی آنها در شناسایی علت مرگ کمک کرد.
نقش داروهای تراتوژن در مدل نقص جنینی
داروی تالیدومید
تالیدومید اولین بار در ۱ اکتبر ۱۹۵۷ توسط شرکت داروسازی آلمان غربی Chemie Grünenthal، به بازار عرضه شد. در اوایل سال ۱۹۶۱، پزشکان متوجه افزایش فوقالعاده موارد ثبت شده کودکان با نقص مادرزادی شدند و به زودی این فرضیه را مطرح کردند که زنان بارداری که تالیدومید مصرف می کنند بیش از حد طبیعی در معرض خطر سقط خود به خودی و به دنیا آوردن کودکانی با ناهنجاری های رشدی مانند اندام کوتاه، غایب یا اضافی و همچنین انواع نقایص قلب، گوش و اندام های داخلی هستند.
تا مارس ۱۹۶۲ بسیاری از کشورها تالیدومید را ممنوع کرده بودند، اما تا آن زمان بیش از ۱۰۰۰۰ نوزاد در سراسر جهان با نقایص مادرزادی منتسب به تالیدومید متولد شدند.
این نقایص مادرزادی محققان و نهادهای دولتی را با چالش جدیدی روبرو کرد، زیرا آزمایشها در موشهای آزمایشگاهی هیچ نشانهای از خطر تراتوژنیک را نشان نداده بود. خشم عمومی به دلیل فقدان مقررات سختگیرانه در رابطه با آزمایش دارو ها به وجود آمد. این خشم، انگیزه یک بحث علمی در مورد اثربخشی استفاده از ارگانیسمهای مدل، مانند موش، در تولید دارو شد. در سال ۱۹۶۲، محققان در سراسر رشته های علمی مطالعاتی را در مورد اثرات تراتوژنیک تالیدومید در موجودات مختلف آغاز کردند. رایج ترین موجودات مدل جنینی مورد استفاده شامل خرگوش، موش صحرایی و موش بود.
در سال ۱۹۶۳، جوزف دی پائولو، در مورد نقایص مادرزادی مختلفی که در جنین موش هایی که مادرانشان روزانه با تالیدومید تغذیه می شدند، تنها یک نوع ناهنجاری تحلیلی در جنین ها یافت. برخی از جنین ها در رحم مرده بودند.
در سال ۱۹۶۵، J.D. McColl و همکارانش در مطالعه خود با عنوان “اثر برخی از عوامل درمانی بر روی جنین موش صحرایی در حال رشد” در موشها افزایش نرخ تحلیل بافتی را مشاهده کردند، اما هیچ اثری از عدم وجود یا رشد غیرطبیعی اندامها را مشاهده نکردند. در انسان کوتاهی اندام در فرزندان یک ناهنجاری مادرزادی شایع است که ناشی از مصرف تالیدومید توسط زنان باردار است. این ناهنجاری در اثر قرار گرفتن در معرض دارو در یک دوره زمانی کوتاه در رشد جنین اولیه انسان ایجاد می شود.
دانشمندان در مورد ویژگی کلیدی جنین جوندگان که به آنها در برابر اثرات تراتوژنیک تالیدومید مقاومت می کند، اتفاق نظر داشتند. جنین های موش و موش صحرایی هر دو دارای آنتی اکسیدان های سازگارتر نسبت به جنین های انسان هستند. این آنتی اکسیدان های موش و موش صحرایی از جنین های خود در برابر رادیکال های آزاد مضری که تالیدومید وارد جنین های در حال رشد می کند محافظت می کند.
داروهای ضد صرع (AEDs)
یکی از مهم ترین عوارض داروهای ضد صرع (AEDs) افزایش ناهنجاری های مادرزادی است. خطر افزایش یافته ناهنجاری در چنین جنین هایی ۷-۱۰ درصد در مقایسه با ۲-۴ درصد در جمعیت عمومی است.
داروی لاموتریژین با اثرات تراتوژنیک کمتری نسبت به داروهای قدیمی تر معرفی شده است. اخیراً برخی ناهنجاریهای مربوط به مصرف لاموتریژین در انسان گزارش شده است، اما گزارشها ناچیز و متناقض بوده و الگوی خاصی از ناهنجاریها ارائه نشده است. نتایج مطالعات نشان داد که لاموتریژین می تواند به عنوان یک عامل خطر برای افزایش ناهنجاری ها در دام های تحت درمان در نظر گرفته شود. تعدادی از محققین بر این باورند که کاهش فولات و متیونین سرم در بروز ناهنجاریها مؤثر بوده است.
دولوتگراویر (DTG)
دولوتگراویر (DTG) یک دارو برای افراد مبتلا به HIV است، اما اثرات آن بر روی جنین به طور کامل شناخته نشده است. قرار گرفتن در معرض DTG با افزایش نرخ نقص لوله عصبی همراه است، این امر منجر به عدم اطمینان در مورد استفاده از DTG در زنان دارای پتانسیل باروری شده است.
موهان و همکاران در سال ۲۰۲۱، سمیت جنینی DTG را در موش بررسی کردند. یافته های آنها نشان داد استفاده از DTG در بارداری منجر به افزایش وقوع نقص لوله های عصبی می شود.
برای مشاهده سایر مطالب مدل های حیوانی کلیک کنید
مطالب مرتبط: القا مدل PCO –ایجاد مدل آزواسپرمی
خدمات مرتبط: انجام تکنیک وسترن بلات با بانکی غنی از انواع آنتی بادی – پژوهش و مطالعه بروی حیوانات آزمایشگاهی