⭐آنچه در این مطلب خواهید خواند
وسترن بلات (پروتئین بلاتینگ یا ایمنو بلاتینگ) یک روش بسیار قدرتمند و مهم برای شناسایی پروتئین ها است. وسترن بلاتینگ را به نام های دیگری از جمله ایمنوبلات (immunoblot) یا پروتئین بلاتینگ ( Protein Blotting ) نیز می شناسند. از وسترن بلات اغلب در تحقیقات پزشکی برای جداسازی و شناسایی پروتئین ها استفاده می شود که با استفاده از این روش، شناسایی اختصاصی پروتئین هدف با آنتیبادی اختصاصی صورت می گیرد.
ویدیو آموزش مرحله به مرحله وسترن بلات
برای اطلاع از انواع آنتی بادی های موجود و دریافت مشاوره رایگان در مورد مسیر های سیگنالینگ انواع آنتی بادی ها اینجا کلیک کنید
برای اطلاع از هزینه تکنیک وسترن بلات کلیک کنید
تاریخچه استفاده از تکنیک وسترن بلات
در اواخر دهه ۱۹۷۰، در ابتدا Towbin و همکاران پروتئین ها را بوسیله ژل پلی آکریل آمید جدا کرده و به غشای نیتروسلولز انتقال دادند. بعد از آن Burnette، در روش جداسازی از ژل پلی آکریل آمید از آن استفاده کرد که منجر به روش وسترن بلات گردید.
وسترن بلات از تکنیک ساترن بلات ( Southern blotting ) که جهت تشخیص و شناسایی قطعات DNA جدا شده بوسیله ژل الکتروفورز مورد استفاده قرار میگیرد، تکامل یافته است. وسترن بلات، همچنان در تحقیقات و طرح های پژوهشی روز دنیا به عنوان ابزاری کاربردی و دقیق، جهت شناسایی پروتئین ها مورد استفاده قرار می گیرد. از این رو استقبال گستردهای از آموزش وسترن بلات از سوی دانشجویان علوم پزشکی و سایر محققان بیولوژی به عمل آمده است.
دلایل و کاربرد استفاده از تکنیک وسترن بلات
یکی از تکنیکهایی که در مسیر تحقیق و توسعه تولید داروهای پزشکی و تشخیص و درمان به پژوهشگران و بیولوژیست ها کمک زیادی کرده است، تکنیک وسترن بلات (Western blot) میباشد.
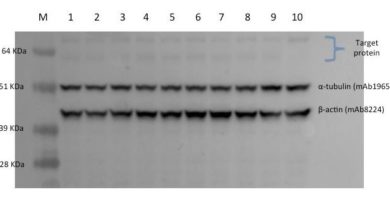
شناسایی و اندازه گیری بیـان پروتئیـن در بافتهـا در تمام آزمایشـگاه های تحقیقاتی سلولی مولکولی، علوم و اعصاب، ژنتیکی، بیوشیمیایی و سایر مراکز تخقیقاتی و دانشگاه ها ضـروری اسـت. وسترن بلات نتایـج کیفـی قابل قبولی بـرای تعییـن محتـوای پروتئیـن هـدف در نمونه های سلولی و بافتی به محقق نشان می دهد که در نهایت با کمی کردن این نتایج کیفی، تـشخیص بیـان پروتئیـن را به طور دقیق بر ما آشکار می کند.
دلایلی زیادی از جمله تشخیص بیماریها در نمونههای بیولوژیکی، شناسایی پروتئینهای آلرژیزا در نمونه های غذایی و غیره وجود دارد که دانشجویان علوم پایه پزشکی، به خصوص محققین بیولوژی، نیاز به شناسایی و تعیین اندازه یک یا چند پروتئین از بین ترکیبی از پروتئین های استخراج شده از نمونه، با استفاده از یک تست آزمایشگاهی با اهمیت و با کارآیی بالا دارند.
موارد مهم و قابل تأمل در انجام آزمایش وسترن بلات
- یکی از نکات مهم در انجام تکنیک وسترن بلات، خطایابی و حل مشکلات به وجود آمده جهت رسیدن به نتیجه درست میباشد. در صورتی که شما در حین انجام این آزمایش با مشکل مواجه شدید میتوانید به صفحه راهنمای تخصصی عیب یابی تکنیک وسترن بلات مراجعه کنید .
- دومین مورد پر اهمیت در انجام تکنیک وسترن بلات میتوان به مواد مورد نیاز و تجهیزات لازم وسترن بلات اشاره کرد.
- مورد بعد که از اهمیت بالایی برخوردار است، انجام دقیق و گام به گام مراحل وسترن بلات توسط کارشناس آزمایشگاه یا دانشجویان می باشد که در این مقاله به طور کامل به یادگیری آن می پردازیم.
مراحل تست وسترن بلات ( پروتکل اجرایی وسترن بلات )
وسترن بلات تکنیکی بر پایه آنتیبادی است که به جهت جداسازی پروتئین مجهول، تعیین اندازه و نوع پروتئین در نمونه بیولوژیکی مورد استفاده قرار میگیرد. این تکنیک بطور کلی شامل سه مرحله اساسی است :
- جداسازی پروتئین ها بر اساس اندازه
- انتقال به غشاء جامد
- نشاندار کردن پروتئین هدف با آنتی بادی اولیه و ثانویه مناسب جهت تشخیص
بطور خلاصه، در تکنیک وسترن بلات، پروتئینها در نمونه های محلول، به وسیله ژل الکتروفورز جدا و به دنبال انتقال آنها به غشا، با آنتیبادیهای اختصاصی هدف نشاندار میشوند. نهایتا با شناسایی آنتیژن سطحی پروتئین هدف توسط آنتیبادی اختصاصی، بیان یا عدم بیان پروتئین، اندازه و مقدار پروتئین مجهول تشخیص داده میشود.
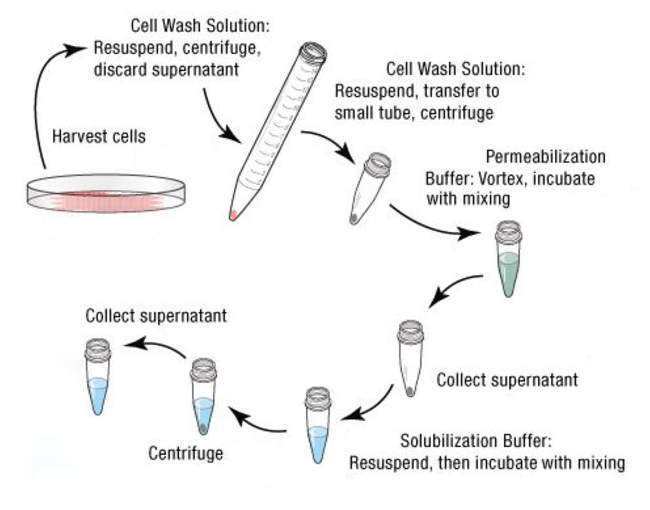
مرحله اول : استخراج پروتئین در نمونه های سلولی و بافتی
قبل از شروع پروتکل وسترن بلات، گام اساسی آماده سازی نمونه است. تیمار مناسب و پروتکل صحیح استخراج پروتئین از انواع مختلف نمونه ها مانند خون، سلول و بافت، میتواند در نتایج نهایی وسترن بلات موثر باشد.
- استخراج پروتئین از نمونه های سلولی
اگر نمونه مورد نظر، سلول کشت داده شده در آزمایشگاه و از نوع سلولهای چسبنده باشد، سلول پس از شست و شو با بافر PBS، با تریپسین به صورت معلق در می آید. سلولها را به مدت ۵ دقیقه و با دور ۱۵۰۰ RPM سانتریفیوژ و مایع رویی را دور می ریزیم. سپس پلت رسوب داده شده را با بافر لیزکننده و یا بافر مهارکننده پروتئاز تیمار می کنیم تا برای رعایت درست زنجیره سرمایی، آن را در دمای منفی بیست درجه سانتی گراد نگهداری کنیم.
- استخراج پروتئین از نمونه های بافتی
ابتدا بافت های تازه یا منجمد را هموژنایز کرده و سپس با استفاده از بافر لیزکننده و مهارکننده پروتئاز نمونه بافتی لیز میشود و در نهایت محلول لیز شده را سانتریفیوژ کرده و مایع رویی (مخلوط پروتئین) را به یک لوله استریل انتقال داده و محتویات استخراج شده را تا انجام بقیه مراحل، روی یخ یا در دمای ۲۰- درجه سانتیگراد نگهداری کنیم که از دناتوراسیون یا تخریب پروتئینها جلوگیری شود.
مرحله دوم : تعیین غلظت پروتئینهای موجود در نمونه
بعد از استخراج، غلظت پروتئین برای وسترن بلات در طول موج ۲۸۰ نانومتر به وسیله دستگاه اسپکتروفوتومتر انجام میشود. این روش در صورتی کارآمد است که مواد جذب کننده دیگر در محلول حاوی پروتئین نباشد. در غیر این صورت، باید از روش برادفورد یا تکنیک لوری استفاده گردد. اگر غلظت پروتئین استخراج شده به اندازه کافی نباشد، بهتر است پروسه استخراج تکرار شود.
برای آموزش کامل تعیین غلظت در اینجا کلیک کنید
مرحله سوم : آماده سازی ژل، نمونه ها و انجام الکتروفورز
مرحله بعدی، جداسازی پروتئینها بر اساس وزن مولکولی یا بار الکتریکی ماکرومولکول است. که به کمک دستگاه الکتروفورز به نام SDS-PAGE انجام میشود. لازم به ذکر است که روش جداسازی به هدف نهایی از آنالیز نیز بستگی دارد. مثلاً جهت تهیه یک عکس شفاف با رزولوشن بالا از یک پروتئین در محلول آبی، ابتدا باید نمونهها پس از سانتریفیوژ کامل، بخش شفاف محلول در ژل الکتروفورز لود شود.

ژل مورد استفاده از دو بخش separation gel برای موقعیت ران نمونه پروتئینی و stacking gel به عنوان محل قرارگیری چاهک ها تشکیل شده است. غلظت ژل به اندازه پروتئین هدف بستگی دارد مثلا برای پروتئین های با وزن مولکولی کمتر از ۲۰ کیلودالتون، ۲۰% و برای نمونههای بزرگتر از ۲۰۰ کیلودالتون، ۷.۵% است. پس از آماده سازی ژل، ladder و نمونهها به همراه loading buffer به مدت ۵ دقیقه در ۱۰۰ درجه سانتیگراد حرارت داده می شود و سپس در چاهکهای ژل تزریق میشوند. نسبت loading buffer به نمونه پروتئینی، ۱ به ۱ میباشد. اگر حجم نمونه خیلی کم باشد از آب دیونیزه برای افزایش حجم استفاده می شود. نهایتاً پروتئینها روی ژل SDS-PAGE به علت بار منفی برموفنل بلو موجود در لودینگ بافر از کاتد به آند حرکت کرده و تفکیک میشوند. حرکت پروتئینها در ژل به علت رنگ آبی بافر لودینگ نیز قابل مشاهده است. ضخامت باندهای ایجاد شده به مقدار پروتئین بستگی دارد. هرچه مقدار پروتئین هدف بیشتر باشد ضخامت باند ایجاد شده، چنانچه حین کار خطایی رخ نداده باشد، بیشتر می باشد.
یادآوری : برموفنل بلو یک نوع شناساگر رنگی ست با محدوده PH بین ۳ تا ۴.۶ که در انجام آزمایشاتی مانند الکتروفورز ژل آگارز و پلی آکریل آمید مورد استفاده قرار می گیرد. برمو فنل بلو به جهت بار منفی در ژل به سمت DNA یا پروتئین حرکت می کند که سرعت این جا به جایی به چگالی ژل بستگی دارد.
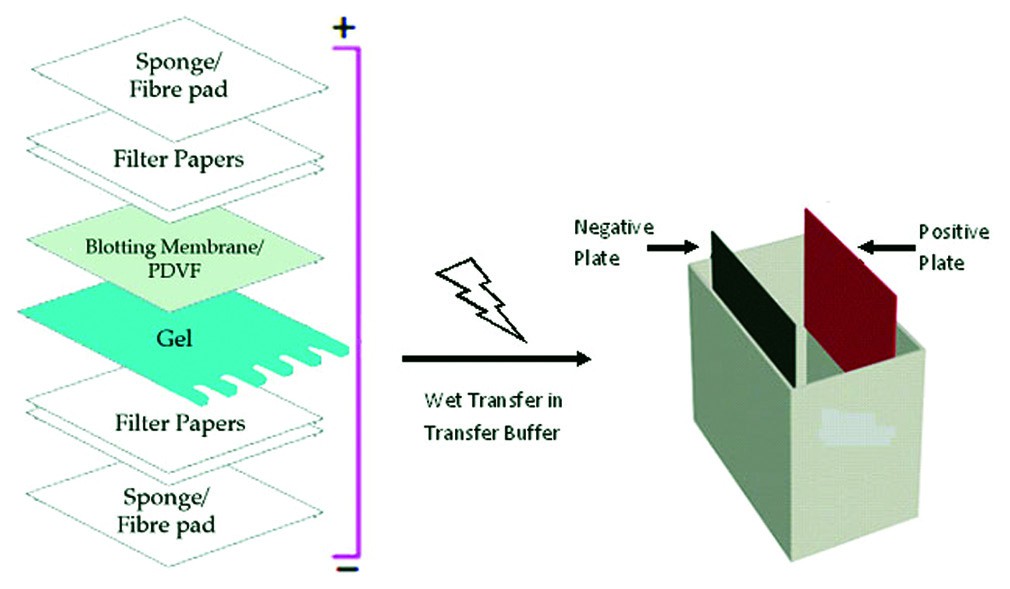
مرحله چهارم : انتقال پروتئینها از ژل به غشاء در تکنیک وسترن بلات
ارزش قدرت تفکیک بالای ژل الکتروفورز تنها پس از ظهور وسترن بلات به کامل ترین پتانسیل خود رسید. انتقال موثر پروتئین ها از ژل به غشاء جامد بستگی زیادی به ماهیت ژل، جرم مولکولی پروتئین های منتقل شده و غشای مورد استفاده دارد. وسترن بلات انتقال پروتئین از ژل SDS-PAGE به غشا را امکان پذیر می کند.
بعد از تفکیک نمونه پروتئینی، پروتئینها باید از ژل آکریلآمید به غشای مناسب انتقال داده شود تا ردیابی آنتیبادی آسان گردد. این غشا به دلیل سرعت بالا در انتقال، معمولا از جنس نیتروسلولز یا پلی-وینیلیدین دی فلوراید ( PVDF) است. کاغذ PVDF به علت داشتن ویژگی اتصال به پروتئینهای سنگینتر بیشتر مورد استفاده قرار میگیرد. جهت انجام مرحله انتقال، ابتدا مقداری از بافر انتقال را در یک ظرف تمیز ریخته و پس از بریدن ژل، بخش متراکم کننده آن در بافر قرار داده شود. اکنون کاغذ PVDF را ابتدا در متانول و سپس در بافر انتقال خیس کرده و همچنین چندین کاغذ صافی دقیقا هم اندازه ژل و دو عدد اسفنج را که قرار است در طرفین غشا و ژل قرار بگیرند، در بافر انتقال قرار داده تا کاملا خیس شوند. سپس اجزای فوق روی هم قرار داده میشود. کاغذهای صافی به تعداد مساوی به همراه یک اسفنج را در دو طرف غشا و ژل قرار داده و نهایتا ساندویچ بلات را در قاب پلاستیکی مربوطه محکم بسته و در تانک بلات که تا ارتفاع مناسب با بافر پر شده، قرار داده میشود. در این مرحله تانک وسترن بلاتینگ بهتر است که در مخزنی از یخ قرار گیرد تا گرمای ناشی از جریان، در پروسه انتقال اختلالی ایجاد نکند.
نکته مهم: هیچ حباب هوایی بین ژل و غشای PVDF نباید وجود داشته باشد و حتی المکان مایعات اضافی خارج شود.
نکته مهم: هیچ حباب هوایی بین ژل و غشای PVDF نباید وجود داشته باشد و حتی المکان مایعات اضافی خارج شود.
مرحله پنجم : بلاکینگ و تشخیص با آنتی بادی اولیه و ثانویه
پس از اتمام مرحله ترانسفر، کاغذ PVDF به منظور حذف اتصالات غیر اختصاصی به جهت تسهیل در تشخیص درست، بهتر است حداقل یک ساعت در محلول بلاکینگ قرار گیرد. از سرم آلبومین گاوی و یا شیر خشک بدون چربی(Skim milk) می توان برای تهیه محلول بلاکینگ نیز استفاده کرد.
بعد از مرحله بلاکینگ، غشای PVDF با رقت مناسب از محلول آنتی بادی اولیه، به مدت یک شبانه روز در دمای ۴ درجه سانتیگراد یا دو ساعت در دمای محیط روی شیکر، انکوبه شود. انتخاب زمان و دمای انکوبه به نوع آنتیبادی بستگی دارد چرا که برخی از آنتیبادی ها در دمای محیط عملکرد و خاصیت خود را از دست میدهند.
در ادامه غشاء با بافر توئین ۲۰ یک درصد یا TBST (Tris-buffered saline with 0.1% Tween 20 به مدت ۵ دقیقه جهت حذف عوامل غیراختصاصی سه مرتبه شستشو داده می شود. در این مرحله آنتیبادی اولیه متصل نشده به پروتئین هدف نیز از غشا جدا میشود.

غشای PVDF در محلول آنتی بادی ثانویه کانژوگه شده با آنزیم آلکالین فسفاتاز یا horseradish peroxidase با رقت مناسب آن آنتی بادی که در کاتالوگ آنتی بادی آورده شده، به مدت ۹۰ دقیقه روی شیکر انکوبه می گردد. مجدد غشاء را با بافر TBST به مدت ۵ دقیقه سه بار شستوشو داده می شود. در نهایت آنتی بادی اولیه به پروتئین هدف و آنتی بادی ثانویه به آنزیم استفاده شونده متصل میگردد.
مرحله ششم : شناسایی با روش ECL (Electrochemiluminescence) و ظهور باندها بر روی فیلم x-Ray
اکنون پروب هایی که نشاندار شده و به پروتئین هدف متصل شدهاند، می بایست شناسایی گردند. روشهای متفاوت از جمله فلوئورسنت، رادیواکتیو، رنگ سنجی و شیمی معدنی یا chemiluminescent مورد استفاده قرار میگیرد.
امروزه عمدتا، از روش ECL به دلیل حساسیت و دقت بالا استفاده می شود. اساس این روش، خاصیت لومینسنتی است که به هنگام در معرض قرار گرفتن کاغذ با آنتی بادی ثانویه کونژوگه شده ایجاد میگردد. لازم به ذکر است که میزان لومینسانس تولید شده به مقدار پروتئین بستگی دارد. در این روش، ابتدا به نسبت مساوی از دو محلول موجود در کیت ECL که به محلول ظهور و ثبوت معروف است، بر روی کاغذ PVDF می ریزیم. ( برای اطمینان از پوشش ECL از پیپت ۱۰۰۰ میکرولیتر استفاده میشود)
نهایتا پس از در معرض قرار گرفتن فیلم در نور قرمز با طول موج مشخص، باندها روی فیلم X-RAY (آشکارکننده) قابل مشاهده می شوند دقت داشته باشیم که تمامی این مراحل وسترن بلاتینک باید در تاریکی انجام شود.
پیشنهاد ما
وسترن بلات تکنیکی است که در تحقیقات بیولوژی مخصوصاً طرح های پژوهشی گرایش های زیست شناسی و سلولی و مولکولی جهت شناسایی و بررسی بیان پروتئین هدف استفاده گسترده ای می شود. اگرچه وسترن بلات، تست بسیار کاربردی و مهم در آزمایشگاه های تحقیقاتی و تشخیصی ست، اما همواره بدست آوردن نتایج غیرقابل انتظار در کنار خطاهای تکنیکی و انسانی در حین انجام آزمایش از مهمترین دغدغه های دانشجویان می باشد. بنابراین می بایست تکنیک وسترن بلات را با دقت بالا و در شرایط آزمایشگاهی پایدار بر اساس پروتکل ستاپ شده RUN کنید.
پیشنهاد می کنیم این تکنیک کاربردی را با مدرن ترین تجهیزات، در کنار کارشناسان با تجربه ما در مجموعه تحقیقاتی و آزمایشگاهی هیستوژنوتک انجام دهید تا کسب نتایج دقیق را با کیفیت بالا و بدون خطای انسانی تجربه کنید و وسترن بلات را به طور کاملاً حرفه ای آموزش ببینید.


برای اطلاع از انواع آنتی بادی های موجود و دریافت مشاوره رایگان در مورد مسیر های سیگنالینگ انواع آنتی بادی ها اینجا کلیک کنید
آموزش تکنیک وسترن بلات
مطالب مرتبط: تکنیک ایمونوهیستوشیمی IHC – تکنیک ایمونوسیتوشیمی – آنتی بادی ها در تست های آزمایشگاهی
خدمات مرتبط: انجام تکنیک وسترن بلات با بانکی غنی از انواع آنتی بادی