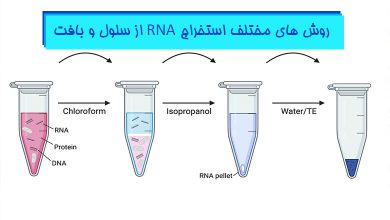
تکنیک استخراج RNA یکی از تکنیک های بسیاری ظریف در تحقیقات علوم زیستی محسوب می شود و هر یک از افرادی که این تکنیک را انجام می دهند تجربیات شخصی، نکات و راهکارهای خاص خود را برای استخراج موفقیت آمیز RNA سالم، از نمونه های بیولوژیکی را دارند. گرچه نتیجه استخراج RNA تا حدی غیر قابل پیش بینی است اما نکاتی وجود دارند که با رعایت آن ها می توان RNA با کیفیت تری را استخراج کرد
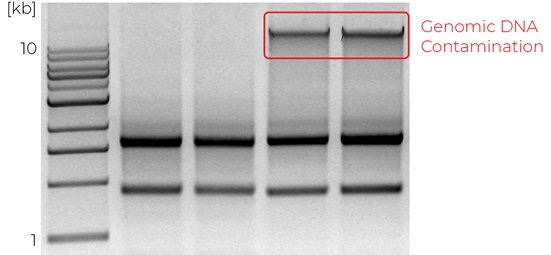
وجود آلودگی ژنومی در نمونه RNA
وجود اسمیر شدید در بالای ژل آگارز پس از اکتروفورز نمونه های RNA یا مشاهده وجود نمونه در داخل چاهک ژل نشان دهنده وجود آلودگی DNA در نمونه های RNA استخراج شده می باشد. همچنین چنانچه نمونه کنترل RT یعنی نمونه حاوی RNA به جای cDNA در طی واکنش PCR دارای محصول PCR باشد نشان می دهد که نمونه RNA آلوده به DNA ژنومی می باشد.
علت
در روش های دستی استخراج RNA همیشه مقادیر اندکی DNA در نمونه RNA استخراج شده وجود خواهد داشت. چنانچه از روش های برپایه فنول مانند ترکیب ترایزول استفاده شود، در مرحله لیز کردن سلول ها یا هموژنایز کردن بافت احتمالا تجذیه مولکول های DNA به خوبی اتفاق نیفتاده و یا اگر در جدا کردن فاز آبی حاوی RNA از مهارت کافی برخوردار نباشید احتمالا در این مرحله DNA همراه RNA کشیده شده و در مرحله بعد همراه RNA رسوب خواهد کرد.
راه حل:
- برای جلوگیری از آلودگی ژنومی، حتما از روش هایی استفاده کنید که در طی آن مولکول های DNA به خوبی شکسته و هموژن شوند.
- در کشیدن فاز آبی حاوی RNA بسیار دقت کنید و سعی نکنید تمام محلول رویی را بردارید.
- در صورتی که RNA استخراج شده حاوی DNA بوده و چاره ای جز استفاده از این RNA ندارید بهترین روش برای از بین بردن آلودگی ژنومی انجام روش DNase treatment پیش از سنتز cDNA می باشد که در طی آن با استفاده از آنزیم DNase محتوای DNA نمونه RNA تجزیه شده و سپس با استفاده از یک ستون تخلیص خود آنزیم نیز از نمونه RNA خارج شده و نهایتا RNA خالص بدست می آید.
RNA تجزیه شده
اگر باندهای rRNA بر روی ژل آگارز به صورت اسمیر دیده می شوند یا باند 18s rRNA بسیار شارپ تر از باند 28s rRNA باشد این نشان می دهد که RNA های استخراج شده ساختار یکپارچه خود را از دست داده و به قطعات کوچکتری تجزیه شدند.
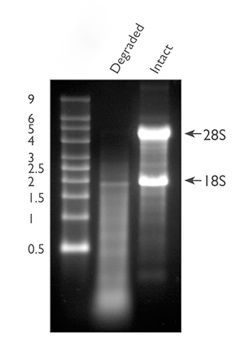
علت
تجزیه و شکسته شدن RNA در تمامی مراحل قبل، در حین و بعد از استخراج RNA قابل رخ دادن است. ممکن است تحت تاثیر مراحل جمع آوری یا شرایط ذخیره سازی نمونه مورد مطالعه رخ دهد. ممکن است در حین فرآیند استخراج RNA اتفاق بیفتد. حتی ممکن است RNA خوبی استخراج شود اما به دلیل نامناسب نبودن شرایط نگهداری RNA های حاصل این تجزیه شدن و از بین رفتن RNA ها رخ دهد.
راه حل
- نمونه های خود را بلافاصله پس از جمع آوری تا زمان استخراج RNA در فریزر ۸۰- درجه یا نیتروژن مایع نگهداری کنید. برای نگهداری نمونه ها در دمای ۲۰- درجه از RNALater استفاده کنید.
- چنانچه تشخیص دادید RNA شما در حین فرآیند استخراج RNA تجزیه می شود در وهله اول سعی کنید تمامی وسایل، مواد و مکانی که به انجام استخراج RNA اختصاص یافته است تمیز و عاری از RNase باشند. همچنین می توانید از ماده بتا-مرکاپتواتانول (BME) به عنوان یک ترکیب از بین برنده آنزیم RNase در بافر لیز کننده خود استفاده کنید تا احتمال تجزیه شدن RNA ها در حین لیز شدن سلول ها یا بافت کاهش یابد. همچنین اگر نمونه های خود را بدون نگهدارنده در فریزر قرار دادید بهتر است پیش از آنکه نمونه کاملا از حالت منجمد شده خارج شود فرآیند لیز کردن نمونه ها را انجام دهید یا در مورد بافت سریع در حضور BME هموژنایز نمایید. دقت کنید بافت مورد نظر باید کاملا لیز شود.
- چنانچه تجزیه RNA مربوط به شرایط نگهداری پس از استخراج می شود. در مرحله اول باید از خلوص آبی که برای حل کردن رسوب RNA استفاده می کنید کاملا مطمئن باشید آب مورد استفاده باید عاری از RNase باشد. همچنین می توانید از DEPC-treated water که در بسیاری از کیت های استخراج RNA عرضه می شود استفاده نمایید.
وجود مهارکننده در RNA استخراج شده
اگر نسبت ۲۶۰/۲۳۰ نمونه RNA کمتر از یک باشد و همچنین ۲۶۰/۲۸۰ پایین باشد معمولا فرآیند بعدی که سنتز cDNA است به درستی انجام نخواهد شد.
علت
نسبت پایین ۲۶۰/۲۳۰ در نمونه های RNA استخراج شده بیانگر وجود نمک گوانیدیوم یا مهارکننده آلی در نمونه RNA است. نمک های گوانیدیوم در ترکیب محلول ترایزول استفاده می شوند چراکه باعث غیرفعال شدن آنزیم RNase می گردند اما در عین حال این نمک ها می توانند فعالیت پروتئین هایی نظیر آنزیم نسخه بردار معکوس (RT) را هم مهار کنند. نسبت پایین ۲۶۰/۲۸۰ بیانگر آلودگی پروتئین در نمونه RNA می باشد.
راه حل
- برای جلوگیری از کاهش نسبت ۲۶۰/۲۳۰ تعداد شستشوهای رسوب RNA با اتانول ۷۵ یا ۸۰ % را افزایش دهید.
- برای جلوگیری از کاهش نسبت ۲۶۰/۲۸۰ سعی کنید مقدار نمونه مورد استفاده متناسب با ظرفیت ستون مورد استفاده در روش های استخراج با کیت یا متناسب با میزان ترایزول مورد استفاده از روش های دستی باشد. در شرایطی که حجم نمونه بسیار بالاتر باشد آلودگی های پروتئین و املاح به طور کامل حذف نخواهند شد. همچنین برای کاهش آلودگی پروتئینی می توانید مرحله اضافه نمودن کلروفرم جهت جداسازی ماکرومولکول ها را دو مرتبه انجام دهید تا RNA خالص تری حاصل گردد.
بازدهی پایین RNA
گاهی RNA بدست آمده از کیفیت خوبی برخوردار است اما مقدار آن از مقدار مورد انتظار بسیار کمتر می شود اصطلاحا بازدهی استخراج RNA پایین است. البته لازم به ذکر است که میزان RNA حاصل به نوع نمونه شامل بافت، سلول، خون و … بستگی دارد. حتی نوع بافت در میزان RNA حاصل تاثیر دارد و در مورد نمونه های خونی این تفاوت از فردی به فرد دیگر مشاهده می شود.

علت
اگر کیفیت RNA خوب بوده اما مقدار آن کم می باشد، ممکن است فرآیند هموژنیزه شدن بافت با لیز سلولی به طور کامل انجام نشده است. در استخراج RNA ، لیز شدن کامل بافت و سلول ها بسیار مرحله کلیدی و مهمی است. استفاده از RNALater برای نگهداری بافت ها می تواند مرحله هموژن کردن بافت را مشکل تر سازد. همچنین ممکن است مقدار بافت یا تعداد سلول مورد استفاده از آنچه تصور می کنید کمتر بوده است. در مورد نمونه های خون، مهارت اپراتور در جمع آوری لایه گلبول های سفید یا buffy coat در مقدار RNA نهایی بسیار تاثیر گذار است.
راه حل
- برای مواردی که میزان RNA کم اما کیفیت آن خوب است روش هموژنایز کردن خود را بهینه نمایید و اطمینان حاصل کنید که بافت مورد نظر به خوبی هموژن شده و سلول ها به طور کامل لیز شدند. در صورت مشاهده قطعات بافت در لیزات حاصل مطمئن باشید که بخشی از RNA موجود را از دست خواهید داد.
- سعی کنید مقدار دقیق و کافی از بافت مورد نظر و یا تعداد دقیقی از سلول های مورد نظر را برای استخراج RNA استفاده کنید.
- اگر علاوه بر مشکل پایین بودن بازدهی RNA، کیفیت RNA استخراج شده نیز نامطلوب است، احتمالا فرآیند هموژنایز کردن طولانی انجام شده و دمای نمونه ها بالا رفته است. سعی کنید در کمتر از یک دقیقه فرآیند هموژنایز کردن نمونه ها را انجام دهید. نمونه های بافت را پس از برش بلافاصله در ترایزول یا دیگر بافرهای لیز کننده سرد قرار دهید تا از فعالیت آنزیم RNase جلوگیری شود.
- در روش های استخراج با کیت، مقدار کافی از بافر elution را جهت رهاسازی RNA از غشای ستون به کار ببرید. هیچ گاه بافر elution را کمتر از مقدار توصیه شده در کیت استفاده نکنید. حتما بعد از اضافه کردن بافر elution حدود دو الی پنج دقیقه ستون RNA را در دما اتاق قرار دهید سپس سانتریفیوژ نمایید. در این حالت رهاسازی RNA از غشا بیشتر صورت می گیرد.
نکته آخر
صرفنظر از نوع نمونه، فرآیند استخراج RNA طبق پروتکل یکسانی انجام می شود. برای تمامی نمونه ها، لیز کردن و هموژنایز کردن نمونه، اولین و مهم ترین مرحله محسوب می شود. در صورتیکه این مرحله به خوبی و به طور کامل صورت گیرد، سلول ها به سرعت لیز شده و RNase سلولی در بافر لیز کننده یا ترایزول غیرفعال می گردد. همچنین در این فرآیند، DNA ژنومی به قطعات کوچکتر شکسته شده و در طی مراحل بعدی بهتر جدا می گردد.
مطالب مرتبط: روش های مختلف استخراج RNA از سلول و بافت – بررسی کمی استخراج RNA با اسپکتروفوتومتر در سلول یا بافت
خدمات مرتبط: استخراج RNA و DNA سنتز cDNA ، طراحی پرایمر ، انجام تکنیک Real time PCR
در صورتی که در مشاهده ویدئو مشکل دارید اینجا یا اینجا کلیک کنید